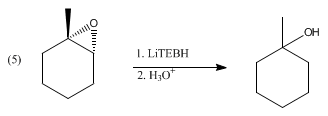இலித்தியம் டிரையெத்தில்போரோ ஐதரைடு

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
இலித்தியம் டிரையெத்தில்போரோ ஐதரைடு
| |
| வேறு பெயர்கள்
மிகைஐதரைடு
LiTEBH | |
| இனங்காட்டிகள் | |
| 22560-16-3 | |
| ChemSpider | 2006168 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 2723993 |
| |
| பண்புகள் | |
| Li(C2H5)3BH | |
| வாய்ப்பாட்டு எடை | 105.95 கி/மோல் |
| தோற்றம் | நிறமற்றது அல்லது மஞ்சள் நிறம் |
| அடர்த்தி | 0.890 கி/செ.மீ3, நீர்மம் |
| கொதிநிலை | 66 °C (151 °F; 339 K) for THF |
| வினைபுரியும் | |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | எளிதில் தீப்பற்றும் அரிக்கும் தீக்காயங்கள் உண்டாக்கும் ஒர் புற்றுநோய் ஊக்கியாக இருக்கலாம். |
| பொருள் பாதுகாப்பு குறிப்பு தாள் | External MSDS |
| R-சொற்றொடர்கள் | 11-14/15-19-34 |
| S-சொற்றொடர்கள் | 16-26-33-36/37/39-43-45 |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
இலித்தியம் டிரையெத்தில்போரோ ஐதரைடு (Lithium triethylborohydride) என்பது LiEt3BH என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கரிம போரான் சேர்மம் ஆகும். பொதுவாக LiTEBH அல்லது மிகை ஐதரைடு என அழைக்கப்படும் இச்சேர்மம் ஒரு வலிமையான ஒடுக்கும் முகவராகும். கரிமவுலோக வேதியியலிலும் கரிம வேதியியலிலும் ஒடுக்கியாக இதைப் பயன்படுத்துகிறார்கள். இலித்தியம் போரோ ஐதரைடு , இலித்தியம் அலுமினியம் ஐதரைடு போன்ற ஒடுக்கிகளை விட இலித்தியம் டிரையெத்தில்போரோ ஐதரைடு வலிமையான ஒடுக்கியாகக் கருதப்படுகிறது. நிறமற்று அல்லது வெண்மை நிறத் திண்மமாக காணப்படும் இச்சேர்மம், வர்த்தக முறையில் டெட்ரா ஐதரோ பியூரான் கரைசல் என்ற பெயரில் விற்கப்படுகிறது. இதனையொத்த ஒடுக்கும் முகவரான சோடியம் டிரையெத்தில்போரோ ஐதரைடும் தொலுயீன் கரைசல் என்ற பெயரில் வர்த்தக முறையில் விற்கப்படுகிறது.
தயாரிப்பு
[தொகு]இலித்தியம் ஐதரைடுடன் (LiH) டெட்ரா ஐதரோ பியூரானில் (THF) உள்ள டிரையெத்தில்போரேன் (Et3B) சேர்த்து வினைப்படுத்தினால் இலித்தியம் டிரையெத்தில்போரோ ஐதரைடு உருவாகிறது.
LiH + Et3B → LiEt3BH
காற்று மற்றும் ஈரப்பதமில்லா சூழலில் இதனுடைய டெட்ரா ஐதரோ பியூரான் கரைசல்கள் காலவரையற்று நிலைப்புத்தன்மை கொண்டுள்ளன.
பயன்கள்
[தொகு]கார்பனைல் தளப்பொருட்கள்
[தொகு]இலித்தியம் டிரையெத்தில்போரோ ஐதரைடு பரவலாக பல வேதி வினைக்குழுக்களை ஒடுக்குகிறது. ஆல்டிகைடுகள், கீட்டோன்கள், அமில குளோரைடுகள் மட்டுமின்றி எசுத்தர்கள், மூவிணைய அமைடுகள் போன்றவற்றையும் ஒடுக்குகிறது. இச்சேர்மம் சார்ந்த ஒடுக்க வினைகளில் உடனடியாக இலித்தியம் அல்காக்சைடுகள் விளைபொருளாக உருவாகின்றன. தொடர்ந்து இவை நிராற்பகுப்பு வினைக்கு உட்பட்டு ஆல்ககால்கள்களாக மாற்றப்படுகின்றன. கீட்டோன்கள் ஒடுக்க வினையின் விகிதவியல் சமன்பாடு இங்கு தரப்பட்டுள்ளது.
R2CO + LiBHEt3 → R2CHOLi + BEt3
R2CHOLi + H2O → R2CHOH + LiOH
திண்மத்தோற்றத் தடுப்பிலுள்ள தளப்பொருட்களும் 2,2,4,4-டெட்ராமெத்தில்-3-பென்டனோன் ஆக ஒடுக்கப்படுகின்றன.
கார்பாக்சிலிக் அமிலங்களை LiBHEt3 புரோட்டான் நீக்கம் செய்கிறது. ஆனால் உருவாகும் இலித்தியம் கார்பாக்சிலேட்டுகளை இது ஒடுக்குவதில்லை. இதைப் போலவே அமில நீரிலிகளை ஆல்ககால்களாக மாற்றுகிறது. ஆனால் கார்ட்பாக்சிலிக் அமிலங்களை டையால் ஆக ஒடுக்குவதில்லை. இதே காரணத்தினால் லாக்டோன்கள் டையால்களாகவும் α,β-ஈனோன்கள் 1,4- கூட்டு வினையினால் இலித்தியம் ஈனோலெட்டுகளாகவும் மாற்றமடைகின்றன. டைசல்பைடுகள் தயோலேட்டுகள் வழியாக தயோல்களாக ஒடுக்கமடைகின்றன.
பிற தளப்பொருட்கள்
[தொகு]LiBHEt3 , ஆல்க்கைல் ஆலைடுகளை ஆல்க்கேன்களாக ஒடுக்குகிறது [1]. LiBHEt3 உடன் எப்பாக்சைடுகள் சேர்த்து சூடுபடுத்தினால் வளைய திறப்பு வினை நிகழ்ந்து ஆல்ககால்கள் உருவாகின்றன. சமச்சீர்மையற்ற எப்பாக்சைடுகள் உயர் தெரிவுநிலை வினைவழியாக மார்கோனிக்காவ் ஆல்ககால்களாக உருவாகின்றன. உதாரணமாக, 1,2-எப்பாக்சிபியூட்டேன் 1-மெத்தில்சைக்ளோயெக்சனால் ஆக ஒடுக்கமடைகிறது.
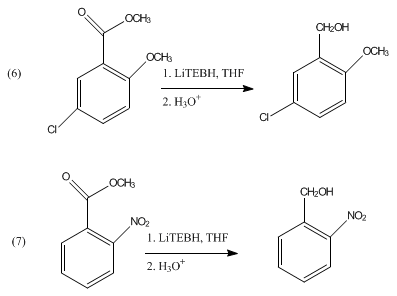
அசிட்டால்க்களும் கீட்டால்களும் LiBHEt3. சேர்மத்தால் ஒடுக்கப்படுவதில்லை. மெசிலேட்டுகளையும், டொசிலேட்டுகளையும் LiBHEt3. சேர்மத்தைப் பயன்படுத்தி ஒடுக்கப் பிளவு வினையில் பயன்படுத்த முடியும் [2]. தெரிவு செய்யப்பட்ட மூன்றாம்நிலை என்-அசைல் தொகுதிகளை LiBHEt3 சேர்மம் எந்த பாதிப்பும் இல்லாமல் பாதுகாப்புக் குழுவை நீக்கம் செய்கிறது [3]. மேலும் அரோமாட்டிக் எசுத்தர்களை தொடர்புடைய ஆல்ககால்களாக சமன்பாடு 6,7 இல் உள்ளபடி ஒடுக்கம் செய்கிறது.
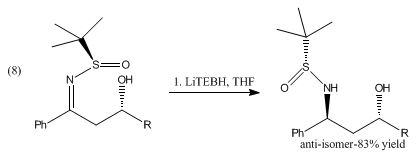
LiBHEt3 சேர்மம் மேலும், பிரிடின், ஐசோகுயினோலின்களை முறையே பிப்பெரிடின், டெட்ரா ஐதரோ ஐசோகுயினோலின்களாக ஒடுக்கமடையச் செய்கிறது [4]. β-ஐதராக்சிசல்பினைல் இமைன்களுடன் LiBHEt3 சேர்மமும் கேட்டகால்போரேனும் சேர்ந்து சமன்பாடு 8 இன் படி எதிர்-1,3-அமினோ ஆல்ககால்களை உருவாக்குகின்றன [5]
முன் எச்சரிக்கை
[தொகு]LiBHEt3 சேர்மம் தண்ணீர், ஆல்ககால்கள் அல்லது அமிலங்களுடன் தீவிரமாக வினைபுரிந்து வெப்பத்தை வெளிவிடுகிறது. ஐதரசன் மற்றும் பைரோபோரிக் டிரையெத்தில்போரேன் முதலியன உருவாகின்றன[6]
மேற்கோள்கள்
[தொகு]- ↑ Brown, H.C.; Kim, S.C.; Krishnamurthy, S. "Selective reductions. 27. Reaction of alkyl halides with representative complex metal hydrides and metal hydrides. Comparison of various hydride reducing agents" J. Org. Chem. 1980, 45, 1-12. எஆசு:10.1021/jo01293a018
- ↑ Baer, H.H.; Mekarska-Falicki, M. Can. J. Chem. 1985, 63, 3043.
- ↑ Tanaka, H.; Ogasawara, K. Tetrahedron Lett. 2002, 43, 4417.
- ↑ Blough, B.E.; Carroll, F. I. "Reduction of isoquinoline and pyridine-containing heterocycles with lithium triethylborohydride (Super-Hydride®)" Tetrahedron Lett. 1993, 34, 7239. எஆசு:10.1016/S0040-4039(00)79297-5
- ↑ Kochi, T; Tang, T.P.; Ellman, J.A. J. Am. Chem. Soc. 2002, 124, 6518.
- ↑ Marek Zaidlewicz, Herbert C. Brown "Lithium Triethylborohydride" Encyclopedia of Reagents for Organic Synthesis 2001, John Wiley & Sons. doi:10.1002/047084289X.rl148