நைட்ரசன்
| நைட்ரசன் | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
7N
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| தோற்றம் | |||||||||||||||||||||||||
நிறமிலி வளிமம், திரவம், அல்லது திண்மம் திரவ நைட்ரசன் நைதரசனின் நிறமாலைக் கோடுகள் | |||||||||||||||||||||||||
| பொதுப் பண்புகள் | |||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | நைட்ரசன், N, 7 | ||||||||||||||||||||||||
| உச்சரிப்பு | /ˈnaɪtr[invalid input: 'ɵ']dʒən/ NYE-trə-jən | ||||||||||||||||||||||||
| தனிம வகை | அலோகம் | ||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 15, 2, p | ||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
14.0067(2) | ||||||||||||||||||||||||
| இலத்திரன் அமைப்பு | 1s2 2s2 2p3 2, 5 | ||||||||||||||||||||||||
| வரலாறு | |||||||||||||||||||||||||
| கண்டுபிடிப்பு | D. Rutherford (1772) | ||||||||||||||||||||||||
| பெயரிட்டவர் | J. Chaptal (1790) | ||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | |||||||||||||||||||||||||
| நிலை | வளிமம் | ||||||||||||||||||||||||
| அடர்த்தி | (0 °C, 101.325 kPa) 1.251 g/L | ||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி கொ.நி.யில் | 0.808 g·cm−3 | ||||||||||||||||||||||||
| உருகுநிலை | 63.15 K, -210.00 °C, -346.00 °F | ||||||||||||||||||||||||
| கொதிநிலை | 77.36 K, -195.79 °C, -320.33 °F | ||||||||||||||||||||||||
| மும்மைப் புள்ளி | 63.1526 K (-210°C), 12.53 kPa | ||||||||||||||||||||||||
| மாறுநிலை | 126.19 K, 3.3978 MPa | ||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | (N2) 0.72 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | (N2) 5.56 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||
| வெப்பக் கொண்மை | (N2) 29.124 யூல்.மோல்−1·K−1 | ||||||||||||||||||||||||
| ஆவி அழுத்தம் | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 5, 4, 3, 2, 1, -1, -2, -3 (வலுவான காடிய ஆக்ஸைடு) | ||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 3.04 (பாலிங் அளவையில்) | ||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் (மேலும்) |
1வது: 1402.3 kJ·mol−1 | ||||||||||||||||||||||||
| 2வது: 2856 kJ·mol−1 | |||||||||||||||||||||||||
| 3வது: 4578.1 kJ·mol−1 | |||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 71±1 pm | ||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 155 பிமீ | ||||||||||||||||||||||||
| பிற பண்புகள் | |||||||||||||||||||||||||
| படிக அமைப்பு | hexagonal | ||||||||||||||||||||||||
| காந்த சீரமைவு | diamagnetic | ||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 25.83 × 10−3 W·m−1·K−1 | ||||||||||||||||||||||||
| ஒலியின் வேகம் | (gas, 27 °C) 353 மீ.செ−1]] | ||||||||||||||||||||||||
| CAS எண் | 7727-37-9 | ||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | |||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: நைட்ரசன் இன் ஓரிடத்தான் | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
நைட்ரசன் (Nitrogen) (இலங்கை வழக்கு- நைதரசன்) ஒரு தனிமம் ஆகும். இதன் அணு எண் 7. இது ஒரு நிறமற்ற, மணமற்ற, சுவைற்ற ஒரு வாயு ஆகும். வளிமண்டலத்தில் 78.1% அளவிற்கு நைட்ரசன் வாயு நிரம்பியுள்ளது. பிரபஞ்சத்தில் நைட்ரசன் ஒரு பொதுவான தனிமமாகும். சூரிய மண்டலம் மற்றும் பால் வெளியில் உள்ள மொத்த பொருட்களில் நைட்ரசன் ஏழாவது இடத்தைப் பிடிப்பதாக மதிப்பிடப்பட்டுள்ளது. திட்டவெப்பநிலை மற்றும் அழுத்தத்தில் இரண்டு நைட்ரசன் அணுக்கள் சேர்ந்து டைநைட்ரசன் தோன்றுகிறது. இது நிறமும் நெடியும் அற்றதாக ஈரணு வளிமமாக N2 என்ற மூலக்கூற்று வாய்ப்பாட்டுடன் அறியப்படுகிறது. வளிமண்டலத்தில் இதன் பருமன் ஆக்சிசனை விட 4 மடங்கு அதிகமாய் உள்ளது .
தனிம அட்டவணையில் நைட்ரசன் தொகுதியில் (V. A) உள்ள எல்லாத் தனிமங்களும் உலோகம் அல்லது உலோகம் போன்றதாக இருக்க நைட்ரஜன் மட்டும் வளிம நிலையில் இருக்கின்றது. மனித உடலில் இடம்பெற்றுள்ள ஆக்சிசன், கார்பன், ஐதரசன் ஆகியனவற்றுக்கு அடுத்து அதிகமாக 3% அளவுக்கு நைட்ரசன் இடம்பிடித்துள்ளது. காற்றிலுள்ள நைட்ரசன் வாயு உயிர்க் கோளத்திற்குள் வந்து கரிமச் சேர்மங்கள் வழியாக மீண்டும் காற்றில் கலப்பதை நைட்ரசன் சுழற்சி விவரிக்கிறது.
தொழில்ரீதியாக முக்கியத்துவம் வாய்ந்த சேர்மங்களான அமோனியா, நைட்ரிக் அமிலம், சயனைடுகள், அமினோ அமிலங்கள், நியூக்ளிக் அமிலங்கள், அடினோசின் முப்பாசுப்பேட்டு போன்றவை நைட்ரசனைக் கொண்டுள்ளன. தனிமநிலை நைட்ரசனில் வலிமையான முப்பிணைப்புகளும், ஈரணுமூலக்கூறுகளில் அனைத்திலும் இரண்டாவது வலிமையான பிணைப்பாகவும் கருதப்படுகிறது. N2 வை உபயோகமுள்ள சேர்மங்களாக மாற்ற முடியாமல் உயிரினம், தொழிற்சாலை இரு பிரிவுகளும் இதனால் மிகுந்த சிரமங்களை சந்திக்கின்றன. ஆனால், அதேசமயத்தில் எரிதல், வெடித்தல், நைட்ரசன் சேர்மங்களை சிதைத்தல் போன்ற வேதியியல் செயல்முறைகளால் பயனுள்ளவகையில் அளப்பறிய ஆற்றலை பெற முடிகிறது. செயற்கை முறையில் தயாரிக்கப்படும் அமோனியாவும் நைட்ரேட்டுகளும் முக்கியமான உரவகைகளாகும். தண்ணிர் ஊற்றுகளை தூர்ந்து போகவைக்கும் மாசுபொருட்களில் ஒன்றாக நைட்ரேட்டுகள் கருதப்படுகின்றன.
உரங்கள் மற்றும் ஆற்றல் மூலங்களாக பயன்படுவதைத் தாண்டி கரிமச்சேர்மங்களின் பகுதிப்பொருளாக நைட்ரசன் விளங்குகிறது. உயர் வலிமை துணி மற்றும் உயர் பசையில் பயன்படும் சயனோஅக்ரிலேட் தயாரிப்புகளில் பயன்படுத்தப்படும் கெவ்லார் இழையாகவும் நைட்ரசன் பயன்படுகிறது. மருந்தியல் துறையில் நுண்ணுயிர் கொல்லிகள் உட்பட ஒவ்வொரு முக்கிய மருந்திலும் நைட்ரசன் ஒரு முக்கியப் பகுதிப்பொருளாக உள்ளது, மருந்துகள் போல தோற்றமளிக்கும் அல்லது இயற்கை நைட்ரசன் மூலக்கூறுகள் சுட்டி மூலக்கூறுகளாக உள்ளன: உதாரணமாக, கரிம நைட்ரேட்டுகள், நைட்ரோகிளிசரின், நைட்ரோபுருசைடு போன்றவை நைட்ரிக் ஆக்சைடாக வளர்சிதைமாற்றத்தின் போது இரத்த அழுத்தத்தைக் கட்டுப்படுத்துகின்றன. காஃபின் மற்றும் மார்பின் அல்லது செயற்கை அம்படமைன்கள் போன்ற பல்வேறு குறிப்பிடத்தக்க நைட்ரஜன் மருந்துகள், கால்நடை நரம்புக்கடத்திகளின் ஏற்பிகளாக செயல்படுகின்றன.
வரலாறு
[தொகு]
நைட்ரசன் சேர்மங்கள் மிகநீண்ட வரலாற்றைப் பெற்றுள்ளன. எரோடோட்டசு என்ற கிரேக்க வரலாற்றாளர் காலத்திலயே அமோனியம் குளோரைடு அறியப்பட்டிருந்தது. இடைக்காலத்தில் இவை நன்கு அறியப்பட்டிருந்தன. இரசவாதிகள் நைட்ரிக் அமிலத்தைப்பற்றியும் இதர அமோனியம் உப்புகள் நைட்ரேட்டு உப்புகள் பற்றியும் அறிந்திருந்தனர். நைட்ரிக் அமிலம் மற்றும் ஐதரோகுளோரிக் அமிலங்களின் கலவையான இராச திராவகம் பற்றியும் அறியப்பட்டிருந்தது. தங்கத்தை கரைக்கப் பயன்பட்டதால் இதை வேதிப்பொருட்களின் அரசன் என்று அழைத்தனர் [1].
கண்டுபிடிப்பு
[தொகு]இசுக்காட்லாந்து நாட்டு மருத்துவ அறிஞரான டேனியல் ரூதர்போர்டு என்பவர் 1772 ஆம் ஆண்டில் இவ்வாயுவை முதன்முதலில் கண்டறிந்து தனிமைப்படுத்தினார்[2][3]. கார்பனீராக்சைடு வாயுவிலிருந்து இது முற்றிலும் வேறுபட்டது என்றும் அவர் தெளிவுபடுத்தினார்[4]. ஒரு மணி வடிவ ஜாடியில் வளி மண்டலக் காற்றை எடுத்துக் கொண்டு, அதில் ஒரு பொருளை எரித்து அதிலுள்ள ஆக்சிஜன் முழுவதையும் நீக்கிக் கொண்டார். அதனுள் ஒரு உயிருள்ள எலியை விட, அது ஆக்சிஜன் இல்லா வெளியில் உடல் நலக் கோளாறால் பாதிக்கப்பட்டது, இறுதியில் இறந்தும் போனது. இதன் மூலம் ஆக்சிஜன் நீக்கப் பெற்று எஞ்சிய வளி மண்டலக் காற்றை அவர் நைட்ரஜன் என அழைத்தார். காரல் வில்லெம் சீலேவும்[5] என்றி கேவண்டிசும்[6] சோசப்பு பிரீசிட்லி [7] முதலானோர் இதே சமயத்தில் தனித்தனியாக இக்கண்டுபிடிப்பை நிகழ்த்தியுள்ளனர். ஆனால் ரூதர்போர்டின் கண்டுபிடிப்பு முதன்முதலில் வெளியிடப்பட்டதால் நைட்ரசன் வாயுவை கண்டறிந்த பெருமை அவருக்கு உரியதாக ஆனது. 1790 ஆம் ஆண்டு இயீன்- அண்டோயீன்-கிளாடு-சாப்பல் என்பவர் நைட்ரசன் என்ற பெயரை பரிந்துரை செய்தார். நைட்ரசன் நைட்ரிக் அமிலத்திலும் நைட்ரேட்டுகளிலும் காணப்பட்டதால் இபெயரை அவர் பரிந்துரைத்தார். νἰτρον "நைட்டர்" மற்றும் γεννᾶν "உருவாக".என்ற கிரேக்க வேர்சொற்களில் இருந்து நைட்ரசன் என்ற சொல் உருவாக்கப்பட்டுள்ளது. அண்டோயின் இலவாசியே என்பவர் άζωτικός என்ற கிரேக்க சொல்லின் பொருளான "வாழ்க்கை இல்லை" [8] என்ற அடிப்படையில் அசோட் என்ற பெயரை பரிந்துரைத்தார். நைட்ரசன் ஒரு மூச்சடைப்பான் வாயுவாக கருதப்படுகிறது. பிரெஞ்சு, உருசியமொழி, துருக்கி மொழி போன்ற பலமொழிகளில் அசோட் என்ற பெயர் பயன்படுத்தப்பட்டது. ஆங்கில மொழியிலும் ஐதரசீன், அசைடுகள் மற்றும் அசோ சேர்மங்கள் போன்ற சில சேர்மங்களில் இப்பெயர் பயன்படுத்தப்பட்டுள்ளது, நைட்ரசன் தனிம வரிசை அட்டவணையின் 15 ஆவது குழுவில் இடம்பெற்றுள்ள தனிமங்களில் மிகவும் இலேசானது ஆகும். இதனால் இதை நிக்டோசன்[1] என்ற பெயராலும் அழைத்தனர். மூச்சடைக்கும் பண்புகளைக் குறிக்கும் "தடைப்படுதல்" என்ற பொருள் கொண்ட πνίγειν என்ற கிரேக்கச் சொல்லிலிருந்து இப்பெயர் வந்துள்ளது.
ஆங்கிலச் சொல்லான நைட்ரசன் (1974) பிரெஞ்சு மொழி சொல்லான நைட்ரோகீன் என்ற் சொல்லில் இருந்து 1790 இல் இயீன் அண்டோனி சாப்டல் (1756–1832), என்பவரால் உருவாக்கப்பட்டது[9]. நைட்ர என்பது (பொட்டாசியம் நைட்ரேட்டு அல்லது சால்ட்பீட்டர்) கீன் என்பது உற்பத்தி செய்தல் என்ற பொருள் கொண்டது ஆகும். நைட்ரிக் அமிலம் தயாரிப்பதற்கு நைட்ரசன் அவசியமானது என்றும் அது பொட்டாசியம் நைட்ரேட்டிலிருந்து தயாரிக்காப்படுகிறது என்றும் சாப்டல் இதனை பொருள் கொண்டார். பண்டைய காலத்தில் எகிப்தியர்கள் சோடியம் கார்பனேட்டை நேட்ரான் என்று அழைத்தார்கள். இச்சேர்மத்தில் நைட்ரேட்டு எதுவும் இல்லை என்றாலும் இப்பெயரால் சிறிதளவு குழப்பம் நிலவியது[10].
முற்காலத்தில் இராணுவ, தொழில்துறை, மற்றும் வேளாண்மைப் பயன்பாடுகளில் நைட்ரசன் சேர்மங்கள் (சால்ட் பீட்டர் அல்லது பொட்டாசியம் நைட்ரேட்டு ) வெடிமருந்தாகவும் பின்னர் உரமாகவும் பயன்படுத்தப்பட்டன. 1910 ஆண்டில் நைட்ரசன் வாயுவில் மின்சுமை செலுத்துவதால், நைட்ரசனின் புறவேற்றுமை வடிவமான ஓரணு நைட்ரசனாக வீரிய நைட்ரசன் உருவாகிது என லார்டு ரேலெய்க் கண்டறிந்தார் [11]. பாதரசத்துடன் நைட்ரசன் வினைபுரிந்து பாதரச நைட்ரைடு உருவாகும்போது கருவியின் தலைப்புறத்தில் அடர் மஞ்சள் நிறம் மேகமாக உருவாகிறது [12] ஓரளவு மந்தமான வளிமம் என்றாலும் நைட்ரஜன் பல ஆயிரக்கணக்கான வேதிச் சேர்மங்களில் இணைந்திருக்கின்றது. இது வேளாண்மையில் உரமாகவும்,தொழிற்துறையில் உணவுப் பொருளுற்பத்தி மற்றும் அவை கெடாமல் பாதுகாக்கவும், வெடி மருந்து, நஞ்சுப் பொருட்கள், நைட்ரிக் அமிலம் போன்ற வேதிப் பொருட்களின் உற்பத்திக்கு மூலப்பொருளாகவும் விளங்குகிறது. அம்மோனிய உப்புக்கள் உரமாகப் பயன்படுகின்றன. அம்மோனியாவை ஆக்சிஜனேற்ற வினைக்கு உட்படுத்தி நைட்ரிக் அமிலத்தையும் உற்பத்தி செய்ய முடியும்.
நீண்ட காலமாகவே நைட்ரசனுக்கான ஆதார மூலங்கள் மிகவும் குறைவாகவே இருந்தன. உயிரியல் வழிமுறைகளில் தோன்றும் நைட்ரசனும் வளிமண்டல வேதிவினைகளால்; உருவாகும் நைட்ரேட்டு படிவுகளும் மட்டுமே இதற்குரிய மூலங்களாகக் கருதப்பட்டன. பிராங்க் கேரோ செயல்முறையும் (1895–1899). ஏபர் போச்சு செயல்முறையும் (1908–1913) நைட்ரசன் சேர்மங்களின் பற்றாக்குறையை ஓரளவுக்கு சரிகட்டின. உலகளவில் உணவு உற்பத்தியில் கிட்டத்தட்ட பாதிக்கு மேற்பட்டவை செயற்கை நைட்ரசன் உரங்களைப் பயன்படுத்துகின்றன[13]. ஆசுட்வால்டு செயற்முறையில் (1902) நைட்ரேட்டுகள் தயாரிக்கப்பட்டன. இதிலிருந்து வெடிமருந்துகள் தயாரிக்கப்பட்டு இருபதாம் நூற்றாண்டு உலகப்போரில் பயன்படுத்தப்பட்டன[14][15].
பண்புகள்
[தொகு]இயற்பியல் பண்புகள்
[தொகு]நைட்ரசன் நிறம்,மணம் சுவையற்ற ஒரு வளிமம் ஆகும். இது காற்றை விட மிகச்சிறிதளவே இலேசானது. நீரில் மிகச் சிறிதளவே கரைகிறது. நச்சுத் தன்மையற்றது. காற்றில் எரிவதில்லை. எரிதலின்றி வாழ்க்கைக்கு உறுதுணையாகவும் இல்லை. சுண்ணாம்பு நீரைப் பால்போல வெண்மையாக்குவதில்லை. இதன் அணு எண் 7. அணு நிறை 14.007. அடர்த்தி 1.165 கிகி /கமீ. இதன் உறை நிலையும் கொதி நிலையும் முறையே 70.25 ,77.31 K ஆகும்.
வேதியியல் பண்புகள்
[தொகு]மிகவும் வலுவான மூன்று எதிர்மின்னிப் பிணைப்பு காரணமாக நைதரசன் வாயு (N2) வேதி வினைகளில் மந்தமாக ஈடுபடுகிறது. சற்று உயர்வெப்ப நிலையில் இது மக்னீசியம், இலித்தியம், கால்சியம் போன்ற பல உலோகங்களுடன் கூடி நைட்ரைடுகளை உண்டாக்குகின்றது. அது போலவே அலோகங்களான போரான், சிலிக்கனுடன் வினை யாற்றுகின்றது. இன்னும் கூடுதலான வெப்ப நிலையில் நைட்ரசன் ஆக்சிசனுடன் நேரடியாகக் கூடி அமோனியா மற்றும் நைட்ரிக் ஆக்சைடை உண்டாக்குகின்றது. கார்பன் மின் வில் லின் (Carbon arc)சுடரொளியில் நைட்ரசனுடன் கூடுகிறது. கந்தகமும், ஆலசன்களும் எந்த வெப்ப நிலையிலும் நைட்ரசனுடன் கூடுவதில்லை. துருவ ஒளி என்பது சூரியனிலிருந்து வீசப்படும் மின்னேற்றம் கொண்ட துகள்கள், அயனிகள் வளி மண்டலத்தை ஊடுருவும் போது புவி காந்தப் புலத்தோடு இடையீட்டுச் செயல் புரிந்து வெளிப்படும் ஒளியாகும். நைட்ரசன் மூலக்கூறு ஆரஞ்சு-சிவப்பு ,நீலம் -பச்சை, நீலம்- கருநீலம் மற்றும் ஊதா போன்ற வண்ணங்களைத் துருவ ஒளியில் தருகிறது.

பொதுவாக தாக்கம் குறைவானதாகக் காணப்படும். நைதரசன் வேறு மூலகத்தோடோ சேர்வையோடோ தாக்கமடைந்து சேர்வைகளை உருவாக்கும் செயற்பாடு நைதரசன் பதித்தல் எனப்படும்.
மூலக இலித்தியத்துடன் வினைபுரிந்து இலித்தியம் நைத்திரைட்டை உருவாக்குகிறது.
6 Li + N2 → 2 Li3N
மக்னீசியமும் நைட்ரசனும் வினைபுரிந்து மக்னீசியம் நைட்ரேட்டு உருவாகிறது. .
3 Mg + N2 → Mg3N2
ஏபர் செயல்முறை நைட்ரசனின் வினைகளைப் பயன்படுத்தும் முக்கிய தொழிற் செயற்பாடாகும். N
2 மற்றும் H
2 என்பவற்றை இரும்பு ஆக்சைடு ஊக்கிக்கு மேல் 500 °C வெப்பநிலையிலும் 200 மடங்கு வளிமண்டல அழுத்தத்தில் வினைபுரியச் செய்தால் அமோனியா வாயு உருவாக்கப்படுகின்றது. இவ்வாயு உர உற்பத்தியில் மிகவும் முக்கியமானதாகும்.
அணுவியல் பண்புகள்
[தொகு]
ஒரு நைட்ரசன் அணுவில் ஏழு எலக்ட்ரான்கள் உள்ளன. சாதாரண நிலையில் அவ்வேழு எலக்ட்ரான்களும் 1s2
2s2
2p1
x2p1
y2p1
z எலக்ட்ரான் அமைப்பில் அமைந்துள்ளன. இவ்வமைப்பின்படி 2s மற்றும் 2p ஆர்பிட்டால்களில் ஐந்து இணைதிறன் எலக்ட்ரான்கள் உள்ளன. இவற்றில் p எலக்ட்ரான்கள் மூன்றும் இணையில்லா எலக்ட்ரான்களாகக் காணப்படுகின்றன. அதிகமான எலக்ட்ரான் கவர்திறன் கொண்ட தனிமங்களில் இதுவும் ஒன்றாகும். பௌலிங் அளவுகோலில் 3.04 பௌலிங் அலகுகள் மதிப்பைப் பெற்றுள்ளது. நைட்ரசனை விட எலக்ட்ரான் கவர்தன்மை அதிகமாக கொண்டவை குளோரின் (3.16), ஆக்சிசன் (3.44), புளோரின் (3.98) போன்ற தனிமங்கள் மட்டுமேயாகும்[16].
தனிமங்களின் ஆவர்த்தனப் பண்புகளைப் பின்பற்றும் நைட்ரசன், அதன் ஒற்றைப் பிணைப்பின் சகப்பிணைப்பு ஆரம் 71 பைக்கோமீட்டர்களைப் பெற்றுள்ளது. போரான் (84 பை.மீ), கார்பன் (76 பை.மீ) தனிமங்களைவிட இது குறைவாகும். ஆக்சிசன் (66 பை.மீ), புளோரின் (57 பை.மீ) தனிமங்களை விட இதன் சகப்பிணைப்பு ஆரம் அதிகமாகும். நைட்ரைடு எதிர்மின் அயனி N3− மிக அதிகபட்சமாக (141 பை.மீ) மதிப்பைப் பெற்றுள்ளது. இதே போல ஆக்சைடு எதிர்மின் அயனி O2−: (140 பை.மீ), புளோரைடு எதிர்மின் அயனி F− (140 பை.மீ) மதிப்புகளைக் கொண்டுள்ளன[16]. வாயுநிலையிலுள்ள தனித்த அணுவிலுள்ள எளிதாக பிணைக்கப்பட்டுள்ள ஓர் எலக்ட்ரானை நீக்குவதற்கு தேவைப்படும் ஆற்றலே அயனியாக்கும் ஆற்றல் எனப்படும். நைட்ரசனின்முதல் மூன்று அயனியாக்கும் ஆற்றல் மதிப்புகள் 1.402, 2.856, மற்றும் 4.577 மோயூ-மோல்-1 ஆகும். மேலும் நான்கு மற்றும் 5 ஆவது அயனியாக்கும் ஆற்றல்களின் கூடுதல் 16.920 மோயூ-மோல்-1 மதிப்பாக உள்ளது. இத்தகைய உயர் மதிப்புகளால் நைட்ரசனில் நேர்மின்சுமை வேதியியலுக்கு சாத்தியமே இல்லை எனக் கருதப்படுகிறது [17].
2p துணைக்கூட்டில் கோள நோட் இல்லாமல் இருப்பது p தொகுதி முதல் வரிசைத் தனிமங்களின், குறிப்பாக நைட்ரசன், ஆக்சிசன், புளோரின் தனிமங்களின் பல்வேறு பண்புகளை நேரடியாகப் பாதிக்கிறது. 2p துணைக்கூடு மிகவும் சிறியதாகவும் 2s கூடு போல அதே ஆரமும் பெற்று ஆர்பிட்டல் இனகலப்புக்கு வழிசெய்கிறது. மேலும் இதன் விளைவாக 2s மற்றும் 2p கூடுகளிலுள்ள இணைதிறன் எலக்ட்ரான்களுக்கும் உட்கருவுக்கும் இடையில் இருக்கும் நிலைமின்விசை ஈர்ப்பும் அதிக அளவிற்கு உயர்கிறது. இதே காரணத்தினால் இத்தனிமங்களின் மீஇணைதிறன் அறியப்படவில்லை. ஏனெனில் உயர் எலக்ட்ரான் கவர் தன்மையால் சிறிய நைட்ரசன் அணு எலக்ட்ரான் மிகுதி மும்மைய்ய நான்கு எலக்ட்ரான் பிணைப்பில் மைய அணுவாக இருப்பது சிரமமாக உள்ளது. எனவே தனிம வரிசை அட்டவணையின் 15 ஆவது குழுவில் முதலாவதாக இடம்பிடித்துள்ள நைட்ரசன் பாசுபரசு, ஆர்சனிக், ஆண்டிமனி , பிசுமத் போன்ற தனிமங்களின் வேதியியலில் இருந்து அதிக அளவில் வேறுபடுகிறது[18].
நைட்ரசன் தனிமத்தை அதன் கிடைமட்ட அண்டை தனிமங்களான கார்பன் மற்றும் ஆக்சிசனுடனும், அத்துடன் அதன் செங்குத்து அண்டை தனிமங்களான பாசுபரசு, ஆர்சனிக், ஆண்ட்டிமணி மற்றும் பிசுமத் தனிமங்களுடனும் ஒப்பிட்டு நோக்குவது பயனுள்ளதாக இருக்கும். இலித்தியம் முதல் நைட்ரசன் வரையுள்ள 2 வது தொகுதி தனிமங்கள் 3 வது தொகுதி தனிமங்களின் அடுத்த குழுவிலுள்ள மக்னீசியம் முதல் கந்தகம் வரையுள்ள தனிமங்களுடன் மூலைவிட்ட தொடர்பு கொண்டு, போரான் சிலிக்கன் இணையிலிருந்து திடீரென சரிந்து சில ஒற்றுமைகளைக் கொண்டுள்ளன. நைட்ரசன் முதல் கந்தகம் வரை இந்த ஒற்றுமைகள் கட்டுபடுத்தப்பட்டுள்ளன. நைட்ரசன் உயர் எலக்ட்ரான் கவர்தன்மை, ஐதரசன் பிணைப்புக்கு உடனியங்குகிற திறன் மற்றும் தனி இணை எலக்ட்ரான்களை கொடையளித்து அனைவுச் சேர்மங்களை உருவாக்கும் திறன் கொண்ட கார்பனைக் காட்டிலும் ஆக்சிசனுடன் ஒத்துப்போகிறது. கார்பனைப் போல ஓரினவரிசைச் சேர்மங்களை உருவாக்கும் தன்மையை பகிர்ந்து கொள்ளவில்லை. எட்டு நைட்ரசன் கொண்ட சேர்மங்கள் (PhN=N–N(Ph)–N=N–N(Ph)–N=NPh) மட்டுமே இதுவரை கண்டறியப்பட்டுள்ளன. pπ-pπ இடைசெயல்களால் கார்பன், நைட்ரசன், ஆக்சிசன் அணுக்களுடன் பல பிணைப்புகள் உருவாக்கும் செயலுக்கு முன்னுரிமை அளிக்கும் பண்பில் நைட்ரசன் அதன் கிடைமட்ட அண்டைய இரண்டு தனிமங்களுடன் ஒத்துப்போகிறது.
செங்குத்தாக இடம்பெற்றுள்ள அண்டைய தனிமங்களுடன் இப்பண்பு ஒத்துப்போவதிற்கு சாத்தியமில்லை. இதனால் நைட்ரசன் ஆக்சைடுகள், நைட்ரைட்டுகள், நைட்ரேட்டுகள், நைட்ரோ, நைட்ரோசோ, அசோ, ஈரசோ சேர்மங்கள், அசைடுகள், சயனேட்டுகள், தயோசயனேட்டுகள், இமினோ வழிப்பொருட்கள் போன்றவை பாசுபரசு, ஆர்சனிக், ஆண்டிமனி அல்லது பிசுமத்தின் பண்புகளை வெளிப்படுத்துவதில்லை. இதேமுறையினால் பாசுபரசு ஆக்சோ அமிலங்களும் நைட்ரசனுடன் இயைந்திருப்பதில்லை [19].
ஐசோடோப்புகள்
[தொகு]
14N மற்றும் 15N என்ற நிலையான இரண்டு ஐசோடோப்புகளை நைட்ரசன் பெற்றுள்ளது. இவற்றில் 14N ஐசோடோப்பு நைட்ரசனின் பொதுவான ஐசோடோப்பு ஆகும். 99.634% இயற்கை நைட்ரசனால் இது ஆக்கப்பட்டுள்ளது. 15N ஐசோடோப்பு எஞ்சியிருக்கும் 0.366% அளவுக்கு சற்று கனமானது நைட்ரசனால் ஆக்கப்பட்டுள்ளது. இதன்விளைவாக நைட்ரசனின் அணு எடை 14.007 அணு நிறை அலகாக உள்ளது [16]. விண்மீன்களில் நடைபெறும் கார்பன் – நைட்ரசன் –ஆக்சிசன் சுழற்சியில் இவ்விரண்டு நிலையான ஐசோடோப்புகளும் உற்பத்தி செய்யப்படுகின்றன. ஆனால் 14N பொதுவான ஐசோடோப்பின் நியூட்ரான் கவரும் நிலை வினைவேக விகிதத்தை நிர்ணயிக்கும் படிநிலையாகக் கருதப்படுகிறது. உட்கருவில் ஒற்றைப்படை எண்ணிக்கையில் புரோட்டான்கள் நியூட்ரான்கள் கொண்டுள்ள நிலையான ஐந்து ஐசோடோப்புகளில் 14N ஐசோடோப்பும் ஒன்றாகும். 2H, 6Li, 10B, மற்றும் 180mTa என்பவை மற்ற நான்கு ஐசோடோப்புகள் ஆகும்[20].
வளிமண்டலத்தில் நிலையாக ஏராளமாகக் காணப்படும் இவ்விரண்டு ஐசோடோப்புகளும் மற்ற இடங்களில் காணப்படுவதில் வேறுபடுகிறது. உயிரியல் ஆக்சிசனேற்ற ஒடுக்க வினைகளாலும், இயற்கை அமோனியா அல்லது நைட்ரிக் அமிலத்தின்[21] ஆவியாதலால் இயற்கையாக நிகழும் ஐசோடோப்பு பிரிப்பு இதற்குக் காரணமாகும். உயிரியியல் வினைகளான தன்மயமாதல், நைட்ரசனேற்றம், நைட்ரசனீக்க வினைகள் வலிமையாக மண்ணின் நைட்ரசன் இயக்கத்தைக் கட்டுப்படுத்துகின்றன. இதன்விளைவாக தளத்தில் 15N அதிகரிப்பும் விளைபொருள் குறைவும் உண்டாகும்[22].
கன ஐசோடோப்பான 15N முதன்முதலில் 1929 ஆம் ஆண்டு எசு.எம். நௌடு என்பவரால் கண்டுபிடிக்கப்பட்டது. அண்டைய தன்மிமங்களான ஆக்சிசன் மற்றும் கார்பனின் கன ஐசோடோப்புகளின் கண்டுபிடிப்புகளைத் தொடர்ந்து இக்கண்டுபிடிப்பு நிகழ்ந்தது[23]. ஐசோடோப்புகளில் குறைவு வெப்பநிலை நியூட்ரான் பற்றுகைப் பரப்பை இது வழங்குகிறது [24] அணுக்கரு காந்த ஒத்ததிர்வு நிறமாலையியலில் இக்கன நைட்ரசன் அதிகமாக பயன்படுத்தப்படுகிறது. நைட்ரசன் கொண்டுள்ள மூலக்கூறுகளின் கட்டமைப்பை உறுதி செய்வதில் இச்சோதனை பயன்படுகிறது. கோட்பாடுகளின்படி 14N ஐசோடோப்பும் பயனுள்ளதாக இருந்தாலும், 1 என்ற முழு எண்ணை சுழற்சியாகக் கொண்டும் நான்முனைத் திருப்புத்திறனை பெற்று அதிகப் பயனற்ற நிறமாலையாக உள்ளது[16]. 15N அணுக்கரு காந்த ஒத்திசைவு நிறமாலையில் சிக்கல்கள் இருந்தாலும் 1H மற்றும்13C நிறமாலையில் தோன்றும் சிக்கல்கள் போலிருப்பதில்லை. இயற்கையில் 15N ஐசோடோப்பு குறைவான அளவே காணப்படுவதால் (0.36%) குறிப்பிடத்தக்க அளவு உணர்திறனை குறைக்கிறது. குறைவான சுழிகாந்த விகிதம் மட்டுமே இங்கு பிரச்சினையாகும். (1H ஐசோடோப்புடன் ஒப்பிடுகையில் அதைவிட10.14% குறைவு) இதன் விளைவாக அதே காந்தப்புல வலிமையில் குறிப்பலை ஓசை இடையிலான விகிதம் 15N ஐசோடோப்பைவிட 1H ஐசோடோப்பு 300 மடங்கு அதிகமாகக் கொண்டுள்ளது[25]. வேதிப்பரிமாற்றம் அல்லது பின்னக் காய்ச்சி வடித்தல் முலம் 15N ஐசோடோப்பை அதிகரிப்பதன் வழியாக இப்பிரச்சினையை ஓரளவுக்கு சமாளிக்கலாம். 15N- மிகுதியாகக் கொண்டிருக்கும் சேர்மங்கள் திட்ட வெப்பநிலை மற்றும் அழுத்தத்தில் தங்களுடைய நைட்ரசனை வளிமண்டல நைட்ரசனுடன் அவை பரிமாறிக் கொள்வதில்லை என்பது கூடுதலாக ஒரு சாதகமாகும். ஐதரசன், கார்பன், மற்றும் ஆக்சிசன் போன்ற ஐசோடோப்புகள் போல் அல்லாமல், இவை வளிமண்டலத்தில் இருந்து விலக்கி வைத்திருக்கப்பட வேண்டும் [16]. நிலையான 15N:14N ஐசோடோப்புகளின் விகிதம் பொதுவாக புவி வேதியியல், தொல்புவி தட்பவெப்பவியல், தொல் கடலியல் போன்ற துறைகளில் பயன்படுத்தப்படுகிறது, இங்கெல்லாம் δ15N என்று அழைக்கப்படுகிறது[26]. 12N முதல் 23N வரையில் செயற்கையாக உருவாக்கப்பட்ட பத்து ஐசோடோப்புகளில் 13N ஐசோடோப்பு மட்டும் 10 நிமிடம் அரைவாழ்வுக் காலம் கொண்டதாகும். எஞ்சிய ஐசோடோப்புகள் யாவும் சில வினாடிகள் அரைவாழ்வுக் காலமே பெற்றுள்ளன. குறிப்பாக 16N ,17N ஐசோடோப்புகள் மில்லிவினாடிகள் மட்டுமே நிலைத்திருக்கின்றன. வேறு நைட்ரசன் ஐசோடோப்புகள் உருவாவதற்கு சாத்தியமில்லை, ஏனெனில் அவை அணுக்கரு இழப்புக் கோட்டுக்கு வெளியே அமைந்து புரோட்டான் அல்லது நியூட்ரானை இழக்கின்றன[27].
கொடுக்கப்பட்ட அரைவாழ்வுக் கால வேறுபாடுகளை நோக்கும்போது 13N ஒரு முக்கியமான கதிரியக்க ஐசோடோப்பாக கருதப்படுகிறது. பாசிட்ரான் உமிழ்பு தளக்கதிர்படயிய்ல் கருவியில் பயன்படுத்தும் அளவுக்கு நீண்ட அரைவாழ்வுக் காலம் கொண்டுள்ளது. 13N ஐசோடோப்பு குறுகிய அரைவாழ்வுக் காலம் கொண்டதுதான் என்றாலும் அது பாசிட்ரான் உமிழ்பு தளக்கதிர்படயிய்ல் கருவியின் அருகிலேயே உற்பத்தி செய்யப்பட்டு பயன்படுத்தப்படுகிறது. சைக்ளோட்ரானில் 16O ஐசோடோப்பை புரோட்டான் மோதல் வழியாக 13N உற்பத்தி செய்தல் இதற்கு உதாரணமாகும். ஆல்பா துகளும் உடன் விளைகிறது[28].
16N என்ற கதிரியக்க கார்பன் அழுத்த நீர் அணுவுலைகளின் அல்லது கொதிநீர் அணுவுலைகளின் சாதாரண இயக்கத்தின்போது குளிர்விப்பியாக ஆதிக்கம் செலுத்துகிறது. இதனால் முதல்நிலை குளிர்விப்பி அமைப்பு முதல் இரண்டாம்நிலை நீராவி சுழற்சி வரை கசிவுகளை கண்டறிவதில் இதுவொரு முக்கியமான மற்றும் உடனடி அடையாளங்காட்டியாக கருதப்படுகிறது. 16O ஐசோடோப்பிலிருந்து நியூட்ரான் புரோட்டான் வினை வழியாக 16N உற்பத்தி செய்யப்படுகிறது. இவ்வினையில் ஒரு நியூட்ரான் கவரப்பட்டு ஒரு புரோட்டான் வெளியேற்றப்படுகிறது. குறுகிய 7.1 வினாடிகள் மட்டுமே இதன் அரைவாழ்வுக் காலமாகும் [27]. ஆனால் மீண்டும் இது 16O ஆக சிதைவடையும்போது உயர் ஆற்றல் காமா கதிர்வீச்சை உற்பத்தி செய்கிறது. (5 முதல் 7 மெகா எலக்ட்ரான் வோல்ட்டு) [27][29]. இந்த காரணத்தால் அழுத்த நீர் அணு உலைகளில் முதனிலை குளிர்விப்பியாக இதைப் பயன்படுத்துவதைப் போல ஆற்றல் அணு உலை செயல்பாடுகளில் இதை தவிர்க்க வேண்டும்[29].
நைட்ரசன் வேதியியலும் சேர்மங்களும்
[தொகு]புறவேற்றுமை வடிவங்கள்
[தொகு]அணு நைட்ரசன் என்றும் அழைக்கப்படும் வீரிய நைட்ரசன், மூவியங்குறுப்பாக மூன்று இணையில்லா எலக்ட்ரான்களைக் கொண்டிருப்பதால் மிகவும் வினைத்திறன் மிக்கதாக உள்ளது, கட்டற்ற நைட்ரசன் அணுக்கள் எளிதாக பல தனிமங்களுடன் வினைபுரிந்து நைட்ரைடுகளை உருவாக்குகின்றன. கட்டற்ற இரண்டு நைட்ரசன் அணுக்கள் ஒன்றுடன் ஒன்று மோதி கிளர்வு நிலை N2 மூலக்கூறுகளை உருவாக்குகின்றன. இம்மோதலின் போது அதிக அளவு ஆற்றல் வெளியிடப்படுகிறது. கார்பனீராக்சைடு, தண்ணீர் போன்றவற்றில் சமபிளவு வினையில் CO மற்றும் O அல்லது OH மற்றும் H இயங்குறுப்புகள் தோன்றும் வினையை இது ஒத்துள்ளது. 0.1-2 மில்லிமீட்டர் பாதரச அழுத்தத்தில் நைட்ரசன் வாயு வழியாக மின்சாரத்தைச் செலுத்தும் போது மென்மஞ்சள் நிற ஒளிர்வுடன் அணு நைட்ரசன் உற்பத்தியாகிறது. மின்சாரம் செலுத்துவது நிறுத்திய பின்பும் பல நிமிடங்களுக்குப் பிறகு இவ்வொளிர்வு மெல்ல மறைகிறது [19].
அணு நைட்ரசன் பெரும் வினைத்திறன் கொண்டதாக இருக்கையில், அடிப்படை நைட்ரசன் வழக்கமாக N2 என்ற மூலக்கூறாக, டைநைட்ரசனாக தோன்றுகிறது. செந்தர நிலையில் இம் மூலக்கூறு நிறமற்று, மணமற்று மற்றும் சுவையற்று டையாகாந்த வாயுவாக உள்ளது -210 ° செல்சியசு வெப்பநிலையில் உருகுவதாகவும் -196 ° செல்சியசு வெப்பநிலையில் கொதிக்கும் பண்பையும் கொண்டுள்ளது [19]. அறை வெப்பநிலையில் டைநைட்ரசன் பெரும்பாலும் வினைபுரிவதில்லை. ஆனால் இலித்தியம் உலோகத்துடனும் சில இடைநிலை உலோக அணைவுகளுடனும் வினைபுரிகிறது. ஏனெனில் இதில் இடம்பெற்றுள்ள தனித்துவமான N≡N முப்பிணைப்பு இதற்குக் காரணமாகும். முப்பிணைப்புகள் மிகவும் குறுகலானவையாகவும் அதிக பிரிகை ஆற்றல் மிக்கவையாகவும் வலிமையோடு உள்ளன. இங்கு பிணைப்பு நீளம் 109.76 பைக்கோ மீட்டர் மற்றும் பிரிகை ஆற்றல் 945.41கியூ/மோல் ஆகும். இதுவே டைநைட்ரசனின் மந்தவினைக்கு காரணமென்று விவரிக்கப்படுகிறது [19].
சில்படிகள், பலபடிகள் போன்ற பிற நைட்ரசன் வடிவங்கள் தோன்றவும் சாத்தியமுள்ளதாக அறியப்படுகிறது. அவைகளை செயற்கை முறையில் தொகுக்க முடிந்தால், அவற்றை மிக அதிக ஆற்றல் அடர்த்தி மிக்க சக்திவாய்ந்த உந்துபொருளாகவும் அல்லது வெடிபொருளாகவும் பயன்படுத்தப்படுத்த முடியும் [30]. ஏனெனில் அவையாவும் டைநைட்ரசனாக சிதைவடைகின்றன. அவற்றினுடைய முப்பிணைப்பு, N≡N (பிணைப்பு ஆற்றல் 946 கியூ⋅மோல்−1) இரட்டைப் பிணைப்பு, N=N (பிணைப்பு ஆற்றல் 418 கியூ⋅மோல்−1) அல்லது ஒற்றைப் பிணைப்பு, N–N (பிணைப்பு ஆற்றல் 160 கியூ⋅மோல்−1) களை விட வலிமையானது ஆகும். உண்மையில் ஒற்றைப் பிணைப்பைக் காட்டிலும் முப்பிணைப்பின் ஆற்றல் மூன்று மடங்கு அதிகமானதாகும். பெரும்பாலான நடுநிலை பாலிநைட்ரசன்கள் சிதைவுக்கு எதிரான தடையை பெற்றிருப்பதில்லை என்பதுதான் ஒரு மிகப்பெரிய குறைபாடு ஆகும். ஒரு சில விதிவிலக்குகள் இருந்தாலும் அவற்றை தயாரிப்பது மிகவும் சவாலான ஒரு செயலாக உள்ளது. மாறாக, அசைடு (N−3), பென்டசீனியம் (N+5), பென்டசோலைடு போன்ற நேர்மின் அயனி மற்றும் எதிர்மின் அயனி பாலி நைட்ரசன்கள் இதை நன்றாக விளக்குகின்றன [30]. உயர் அழுத்தம் (1.1 மில்லியன் வளிமண்டல அழுத்தம்) மற்றும் உயர் வெப்பநிலையில் (2000 கெல்வின் வெப்பநிலை)யில் வைரபணை செல்லில் இது உற்பத்தி செய்யப்படும்போது நைட்ரசன் ஒற்றை பிணைப்புடன் மறைவுறா கனசதுர படிக அமைப்பில் பலபடியாகிறது. வைரத்தைப் போல அமைப்புடன் வலிமையான சகப்பிணைப்பைக் கொண்டு நைட்ரசன் வைரம் என அழைக்கப்படுகிறது [31].
வளிமண்டல அழுத்தத்தில் மூலக்கூற்று நைட்ரசன் 77 கெல்வின் வெப்பநிலையில் (-195.79 பாகை செல்சியசு) திரவமாக சுருங்குகிறது. திண்ம நைட்ரஜன் இரு வேற்றுருக்களைக் கொண்டுள்ளது. அவற்றை ஆல்பா ,பீட்டா நைட்ரஜன் என்பர். 63 கெல்வின் வெப்பநிலையில் (-210.01 பாகை செல்சியசு) பீட்டா நைட்ரசன் என்ற புறவேற்றுமை வடிவத்தை அடைகிறது[32]. 35.4 கெல்வின் வெப்பநிலையில் (−237.6 ° செல்சியசு) மற்றொரு புறவேற்றுமை வடிவமான ஆல்பா நைட்ரசனாக படிகமாகிறது[33]. திரவ நைட்ரஜன், தோற்றத்தில் தண்ணீரைப் போலவே ஆனால் தண்ணீரின் அடர்த்தியில் 80.8% அடர்த்தியைக் கொண்டிருக்கும் நிறமற்ற திரவமான திரவ நைட்ரசன் ஒரு பொதுவான உறைகலவை ஆகும். கொதி நிலையில் திரவ நைட்ரசனின் அடர்த்தி 0.808 கிராம்/மில்லி ஆகும்[34]. திடநைட்ரசன் பல படிகவியல் மாறுபாடுகளைக் கொண்டுள்ளது. புளூட்டோவின் [35] மேற்பரப்பிலும் டிரைட்டன் போன்ற சூரியக் குடும்பத்தின் புறவெளி நிலவுகளிலும் [36] திடநைட்ரசன் காணப்படுகிறது. குறைவான வெப்பநிலையிலும் கூட திட நைட்ரசன் ஆவியாகும் நிலையில் உள்ள இது பதங்கமாகி வளிமண்டலத்தை உருவாக்குகிறது அல்லது நைட்ரஜன் பனியாக மீண்டும் ஒடுக்கமடைகிறது. இது மிக பலவீனமாகவும் வெப்பநீரூற்று வடிவிலும் பாய்கிறது. துருவப்பனி முகடு மண்டல டிரைட்டன் வெந்நீர் ஊற்றிலிருந்து நைட்ரசன் வாயு வருகிறது [37].
டைநைட்ரசன் அணைவுச் சேர்மங்கள்
[தொகு]
முதலாவதாக கண்டறியப்பட்ட டைநைட்ரசன் அணைவுச் சேர்மம் அருகிலுள்ள படத்தில் காட்டப்பட்டுள்ள [Ru(NH3)5(N2)]2+ அணைவுச் சேர்மம் ஆகும். இதைத் தொடர்ந்து பல அணைவுச் சேர்மங்கள் கண்டறியப்பட்டன. இந்த அணைவுச் சேர்மங்களில் உள்ள நைட்ரசன் மூலக்கூறு குறைந்தபட்சம் ஒரு தனி இணை எலக்ட்ரான் சோடியையாவது மைய்ய உலோக நேர்மின் அயனிக்கு கொடையளிக்கிறது. நைட்ரசனேசில் உள்ள உலோகங்களுடன் N2 எவ்வாறு பிணைந்துள்ளது என்றும் ஏபர் செயல்முறையில் எவ்வாறு வினையூக்கியாகிறது என்றும் விவரிக்கப்படுகிறது. இச்செயல்முறைகளில் டைநைட்ரசனின் பங்களிப்பு உயிரியலிலும் உர உற்பத்தியிலும் மிகவும் முக்கியத்துவம் வாய்ந்ததாக கருதப்படுகிறது [38][39].
ஐந்து வெவ்வேறு வழிகளில் உலோகங்களுடன் டைநைட்ரசன் ஒருங்கிணைகிறது. M←N≡N (η1) மற்றும் M←N≡N→M (μ, பிசு-η1) என்று முடியும் வழிகள் நன்கு வரையறுக்கப்பட்டவையாகும். இவ்வழிகளில் நைட்ரசன் அணுக்களின் மேலுள்ள தனி இணை எலக்ட்ரான்கள் உலோக நேர்மின் அயனிக்குக் கொடையளிக்கப்படுகின்றன. முற்றிலும் வரையறுக்கப்படாத வழிகளில் முப்பினைப்பில் இருந்து தனி இணை எலக்ட்ரான்கள் கொடையளிக்கப்படுகின்றன. இரண்டு உலோக நேர்மின் அயனிகளுடன் (μ, பிசு-η2) பாலம் அமைக்கும் ஈனிக்கு அல்லது ஒரேயொரு (η2) க்கு கொடையளித்த்து ஒருங்கிணைதல் என்பன மற்ற இரண்டு வழிகளாகும். பாலம் அமைக்கும் ஈனியாக மூன்று ஒருங்கிணைப்புகள் பங்கேற்பது தனித்துவம் பெற்ற ஐந்தாவது வழியாகும். இவ்வழிமுறையில் அனைத்து எலக்ட்ரான் இணைகளும் முப்பிணைப்பில் இருந்தே கொடையளிக்கப்படுகின்றன(μ3-N2). சில அணைவுச் சேர்மங்களில் பலமுனை N2 ஈனிகளும், சில அணைவுச் சேர்மங்களில் N2 வெவ்வேறு வழிகளால் பிணைக்கப்பட்டும் காணப்படுவதுண்டு. ஏனெனில் கார்பனோராக்சைடுடனும் (CO) அசிட்டிலீனுடனும் (C2H2) நைட்ரசன் ஒத்த எலக்ட்ரான் எண்ணிக்கையுடையதாக உள்ளது. மேலும்,கார்பனோராக்சைடைக் காட்டிலும் N2 ஒரு பலவீனமான σ- வழங்கி மற்றும் π- ஏற்பி என்றாலும் டைநைட்ரசன் அணைவுச் சேர்மங்களில் பிணைப்பு கார்பனைல் சேர்மங்களின் அணைவுடன் நெருங்கிய கூட்டணியைக் கொண்டுள்ளது. σ கொடையளிப்பது M–N பிணைப்பு உருவாக்கத்தை அணுமதிப்பதில் மிகமுக்கியமான ஒரு காரணியாகக் கருதப்படுகிறது. π- க்கு கொடையளிப்பது N–N பிணைப்பை பலவீனமாக்கும். பக்க (η2) கொடையளித்தலை விட இறுதி (η1) கொடையளித்தல் எளிமையாக நிறைவேற்றப்படுகிறது[19]
இன்று, அனைத்து இடைநிலை உலோகங்களுக்கான டைநைட்ரசன் அணைவுச் சேர்மங்கள் அறியப்பட்டு, பல நூறு சேர்மங்கள் உருவாக்கப்பட்டுள்ளன. பொதுவாக அவை வழக்கமான மூன்று முறைகள் மூலம் தயாரிக்கப்படுகின்றன [19].
1.H2O போன்ற மாறத்தகுந்த ஈனிகளை இடப்பெயர்ச்சி செய்தல், H−, அல்லது CO வை நேரடியாக நைட்ரசன் இடப்பெயர்ச்சி செய்யும். மிதமான சூழ்நிலைகளில் பெரும்பாலும் இவை மீள் வினைகளாகும்.
2.நைட்ரசன் வாயுவின் கீழ் பொருத்தமான இணை ஈனி முன்னிலையில் உலோக அணைவுச் சேர்மங்களை ஒடுக்கமடையச் செய்து தயாரிக்கலாம். டைமெத்தில்பீனைல்பாசுபீன் (PMe2Ph) உதவியால் குளோரைடு ஈனிகளை இடப்பெயர்ச்சி செய்து மூல குளோரின் ஈனிகளைவிட குறைந்த எண்ணிக்கை நைட்ரசன் ஈனிகள் உருவாக்குவது உள்ளிட்ட முறைகள் பொதுவான தெரிவு முறையாகும்.
3. N–N பிணைப்புள்ள ஒரு ஈனியாக மாற்றுவது ஒரு முறையாகும். ஐதரசீன் அல்லது அசைடு போன்றவை நேரடியாக டைநைட்ரசன் ஈனியுடன் இம்முறையில் இணைகிறது.
உலோக அணைவுக்குள் அரிதாக N≡N பிணைப்பு நேரடியாக உருவாகலாம். உதாரணமாக, ஒருங்கிணைந்த அமோனியா (NH3) நேரடியாக நைட்ரசு அமிலத்துடன் (HNO2) உடன் வினைபுரிதலைக் குறிப்பிடலாம். ஆனால் இவ்வினை பொதுவாக பயன்படுத்தக்கூடிய ஒரு வினையல்ல. பெரும்பால டை நைட்ரசன் அணைவுகள் வெண்மை-மஞ்சள்-ஆரஞ்சு-சிவப்பு-பழுப்பு என்ற எல்லைக்குள் காணப்படுகின்றன. சில அணைவுச் சேர்மங்கள் விதிவிலக்காக நீலநிறத்திலும் [{Ti(η5-C5H5)2}2-(N2)] காணப்படுகின்றன[19].
நைட்ரைடுகள், அசைடுகள் மற்றும் நைட்ரிடோ அணைவுகள்
[தொகு]ஈலியம் நியான், ஆர்கான் முதலான முதல் மூன்று மந்த வாயுக்கள், பிசுமத்தை அடுத்துள்ள குறுகிய அரைவாழ்வுக் கால ஆயுள் கொண்ட தனிமங்கள் தவிர, கிட்டத்தட்ட தனிம வரிசை அட்டவணையிலுள்ள எல்லா தனிமங்களுடனும், நைட்ரசன் வினைபுரிகிறது. இவ்வினைகளால் அளப்பரிய வெவ்வேறு பண்புகளும் பயன்பாடுகளும் கொண்ட இரட்டைச் சேர்மங்கள் உருவாகின்றன [19]. பல இரட்டைச் சேர்மங்கள் அறியப்பட்டாலும் நைட்ரசன் ஐதரைடுகள், ஆக்சைடுகள் மற்றும் புளோரைடுகள் விதிவிலக்காகும். பல தனிமங்களுடன் பலவிகிதவியல் அளவுகளிலும் நைட்ரசன் இணைந்துள்ளது. (உதாரணம்: 9.2 < x < 25.3 அளவுகளுக்காக MnN, Mn6N5, Mn3N2, Mn2N, Mn4N மற்றும் MnxN). மேலும் இவற்றை உப்பு போன்றவை என்றும் வைரம் போன்றவை என்றும் வகைப்படுத்துகிறார்கள். பொதுவாக உலோகங்கள் நைட்ரசனுடன் அல்லது அமோனியாவுடன் நேரடியாக வினைபுரிவதால் இவ்வகை சேர்மங்கள் உருவாகின்றன. உலோக அமைடுகளின் வெப்பச் சிதைவு வினையினாலும் இவை உருவாகின்றன :[40]
- 3 Ca + N2 → Ca3N2
- 3 Mg + 2 NH3 → Mg3N2 + 3 H2 (at 900 °C)
- 3 Zn(NH2)2 → Zn3N2 + 4 NH3.
இச்செயல்முறை பல்வேறு வழிமுறைகளில் நடைபெறுகிறது. கார உலோகங்களும் காரமண் உலோகங்களும் மிகுந்த அயனிப்பண்புடைய நைட்ரைடுகளாகும். Li3N (Na, K, Rb, மற்றும் Cs தனிமங்களளும் M3N2 (M = Be, Mg, Ca, Sr, Ba) நிலையான நைட்ரைடுகளாக உருவாவதில்லை. மின்சுமை பகிர்வு நிறைவடையவில்லை என்றாலும் இவை N3− எதிமின் அயனியின் உப்புகளாகக் கருதப்படுகின்றன. எனினும், கார உலோக அசைடுகளும் KN3 யும் நேரியல் N3− எதிமின் அயனியின் உப்புகள் Sr(N3)2 மற்றும் Ba(N3)2 என்பது நன்கறிந்ததே ஆகும். அயனிப்பண்பு குறைந்த தொகுதி 11 முதல் 16 வரையிலான உலோகங்களின் அசைடுகள் சிக்கலான கட்டமைப்பைக் கொண்டுள்ளன. சிறு அதிர்ச்சிகளும் அவற்றை உடனடியாக வெடிக்கச் செய்கின்றன [40]

.

சயனோசன் ((CN)2), முப்பாசுபரசு பென்டாநைட்ரைடு (P3N5), இருகந்தக இருநைட்ரைடு (S2N2), நாற்கந்தக நான்குநைட்ரைடு (S4N4) உள்ளிட்ட பல சகபிணைப்பு இரட்டை நைட்ரைடுகள் அறியப்படுகின்றன. சகபிணைப்பு சிலிக்கன் நைட்ரைடு (Si3N4), சகபிணைப்பு செருமானியம் நைட்ரைடு (Ge3N4) போன்ற சேர்மங்களும் அறியப்படுகின்றன. குறிப்பாக சிலிக்கான் நைட்ரைடு சிட்டங்கட்டுதலுக்கு ஏற்ற ஒரு நம்பிக்கைக்குரிய பீங்கான் தயாரிப்புக்குப் பயன்படுகிறது. குறிப்பாக, குழு 13 நைட்ரைடுகள் பல குறைக்கடத்திகளாக செயற்படுகின்றன. கிராபைட்டும் வைரம், சிலிக்கான் கார்பைடு ஆகியனவற்றுடன் ஒத்த எலெக்ட்ரான் எண்ணிக்கையுடையனவாகவும், ஒத்த கட்டமைப்புக்களையும் கொண்டுள்ளன. குழுவின் கீழே செல்லச் செல்ல இவற்றின் பிணைப்புகள் சகபிணைப்பிலிருந்து அயனிப்பிணைப்பாகவும் உலோகப் பிணைப்பாகவும் மாற்றமடைகின்றன. குறிப்பாக B–N அலகு C–C பிணைப்புடன் ஒத்த எலக்ட்ரான் எண்ணிக்கையைப் பெற்று, போரானுக்கும் நைட்ரசனுக்கும் இடைபட்ட உருவளவை கார்பன் கொண்டுள்ளது. போரசீனில் உள்ள போரான்-நைட்ரசன் பிணைப்புக்கு இக்கோட்பாடு சரியாகப் பொருந்தவில்லை., எலக்ட்ரான் குறைவு காரணமாக போரான் எளிமையாக அணுக்கருநாட்ட தாக்கத்துக்கு உட்படுகிறது. முழுமையாக கார்பனைக் கொண்டுள்ள வளையங்களில் இது சாத்தியமில்லை [40].
நைட்ரைடுகளின் மிகப்பெரிய வகையாக சிற்றிடைவெளி நைட்ரைடு வகை உள்ளது. MN, M2N, M4N போன்ற வாய்ப்பாடுகளைக் கொண்டிருக்கும் இவ்வகை நைட்ரடுகளில், சிறிய நைட்ரசன் அணுக்கள் உலோகக் கனசதுரம் அல்லது அறுங்கோண நெருக்கப் பொதிவு கட்டமைப்புகளின் இடைவெளியில் பொருந்தி நிரம்பியுள்ளன. வேதியியலில் இவை மந்தமானவையாகவும், மிகவும் கடினமான, ஒளிபுகாதனவாகவும் காணப்படுகின்றன. 2500 °செல்சியசு வெப்பநிலைக்கு மேற்பட்ட உயர் வெப்பநிலைகளில் மட்டுமே இவை உருகும். மேலும் இவை உலோகங்கள் போல் மின்சாரத்தைக் கடத்துகின்றன. மிகவும் மெதுவாக நீராற்பகுப்பு அடைந்து அமோனியா அல்லது நைட்ரசனை கொடுக்கின்றன[40].
ஈனிகளில் நைட்ரைடு எதிர்மின் அயனியே (N3−)வலிமையான π கொடையாளி ஆகும். (O2−) நைட்ரைடுக்கு அடுத்த வலிமையான ஈனியாகும். நைட்ரிடோ அணைவுச் சேர்மங்கள் பொதுவாக அசைடுகளை வெப்பச் சிதைவுக்கு உட்படுத்தி அல்லது அமோனியாவை புரோட்டான் நீக்கம் செய்து தயாரிக்கப்படுகின்றன. இறுதியில் உள்ள {≡N}3− குழுவில் இவை ஈடுபடுகின்றன. நேரியல் அசைடு எதிர்மின் அயனி நைட்ரசு ஆக்சைடும் கார்பனீராக்சைடு, சயனேட்டுகள் போன்றவற்றுடன் ஒத்த எலக்ட்ரான் எண்ணிக்கை கொண்டு அணைவுச் சேர்மங்களைக் கொடுக்கிறது. கார்பனேட்டு, நைட்ரேட்டுகளுடன் ஒத்த எண்ணிக்கை கொண்டுள்ள நைட்ரைடுகளும் அறியப்படுகின்றன[40].
ஐதரைடுகள்
[தொகு]
நைட்ரசன் சேர்மமான அமோனியா (NH3) தொழில்ரீதியாக மிக முக்கியமான சேர்மம் ஆகும் வேறு சேர்மங்களைக் காட்டிலும் பெரிய அளவில் இச்சேர்மம் தயாரிக்கப்படுகிறது. ஏனெனில், அமோனியா உணவு மற்றும் உரங்களுக்கு வினையூக்கியாகவும் உலக உயிரினங்களின் சத்துணவில் குறிப்பிடத்தக்க பங்களிப்பையும் அளிக்கிறது. ஒரு நிறமற்ற கார வாயுவான இது காரச் சுவையைக் கொண்டுள்ளது. அமோனியாவின் கட்டமைப்பில் ஐதரசன் பிணைப்பு இருப்பதால். உயர் உருகுநிலை (−78 °செல்சியசு), உயர் கொதிநிலை (−33 °செல்சியசு) போன்ற குறிப்பிடத்தக்க சில விளைவுகளுக்கு உட்படுகிறது. ஒரு திரவமாக அமோனியா நல்லதொரு கரைப்பானாக விளங்குகிறது. குறைந்த பாகுத்தன்மை மற்றும் குறைந்த மின் கடத்து திறன் கொண்டு உயர் மின்கடத்தாப் பொருள் மாறிலி மதிப்பைக் கொண்டுள்ளது. நீரைவிட அடர்த்தி குறைவானதாக அமோனியா காணப்படுகிறது. எனினும், அமோனியாவிலுள்ள ஐதரசன் பிணைப்பு தண்ணீரிலுள்ள ஐதரசன் பிணைப்பைக் காட்டிலும் வலிமை குறைந்தது ஆகும். ஏனெனில் ஆக்சிசனுடன் ஒப்பிடும்போது நைட்ரசனின் எலக்ட்ரான் எதிர்மின் தன்மை குறைவாகும். மேலும், அமோனியாவில் ஒரேயொரு தனி இணை எலக்ட்ரான்கள் மட்டுமே உள்ளது. நீரில் இரண்டு தனி இனை எலக்ட்ரான்கள் உண்டு. நீர்த்த கரைசலில் அமோனியா வலிமை குறைந்த காரமாகச் (காடித்தன்மை எண் 4.74) செயல்படுகிறது. இதனுடைய இணை அமிலம் அமோனியம் ஆகும். மிகவும் வலிமை குறைந்த ஓர் அமிலமாகவும் அமோனியாவினால் செயலாற்ற முடியும். அமிலமாக ஒரு புரோட்டானை இழந்து அமைடு எதிர்மின் அயனியை உருவாக்குகிறது. இதனால் தண்ணிரைப் போலவே இதுவும் தன்பிரிகை அடைந்து அமோனியம் மற்றும் அமைடுகளை உருவாக்குகிறது. அமோனியா காற்றில் எரிந்து நைட்ரசன் வாயுவையும், புளோரினில் எரிந்து பசுமஞ்சள் நிறத்திலான நைட்ரசன் டிரைபுளோரைடையும் கொடுக்கிறது. பிற அலோகங்களுடன் அமோனியாவின் வினை சிக்கல்கள் நிறைந்ததாகும். எனினும் பல கலப்பு விளைபொருட்கள் உருவாகின்றன. உலோகங்களுடன் சேர்த்து அமோனியாவை சூடுபடுத்தினால் நைட்ரைடுகள் உருவாகின்றன.
இரட்டை நைட்ரசன் ஐதரைடுகள் மேலும் பல அறியப்பட்டுள்ளன. ஆனால் ஐதரசீனும் (N2H4) ஐதரசன் அசைடும் (NH2OH) அவற்றில் முக்கியமானவைகளாகும். நைட்ரசன் ஐதரைடாக இல்லாவிட்டாலும் ஐதராக்சிலமைன் (NH2OH) நைட்ரசன் ஐதரைடின் பண்புகளைப் பெற்றுள்ளது. இதன் கட்டமைப்பும் அமோனியாவையும் ஐதரசீனையும் ஒத்துள்ளது. ஐதரசீன் ஒரு புகையும் நிறமற்ற நீர்மம் ஆகும். அமோனியாவின் மணம் கொண்ட இது இயற்பியல் பண்புகளில் நீரை ஒத்துள்ளது. (உருகுநிலை 2.0 ° செல்சியசு, கொதிநிலை 113.5 ° செல்சியசு, அடர்த்தி 1.00 கி•செ.மீ−3). வெப்பங்கொள் சேர்மமாக இருந்த போதிலும், இயக்கவியலின்படி நிலைப்புத்தன்மை கொண்டிருக்கிறது. காற்றில் விரைவாகவும் முற்றிலுமாகவும் எரிந்து வெப்ப உமிழ்வினை மூலம் நைட்ரசனையும் நீராவியையும் கொடுக்கிறது. பயனுள்ள ஒடுக்கும் முகவராகவும் அமோனியாவை விட பலவீனமான காரமாகவும் ஐதரசீன் பயன்படுத்தப்படுகிறது.[42]. ராக்கெட் எரிபொருளாகவும் ஐதரசீனைப் பயன்படுத்துகிறார்கள் [43]. ஊன்பசை அல்லது பசையின் முன்னிலையில் அமோனியாவுடன் கார சோடியம் ஐப்போகுளோரைடை வினைபுரியச் செய்து பொதுவாக ஐதரசீன் தயாரிக்கப்படுகிறது:[42]
- NH3 + OCl− → NH2Cl + OH−
- NH2Cl + NH3 → N
2H+
5 + Cl− (slow) - N
2H+
5 + OH− → N2H4 + H2O (fast).
Cu2+ போன்ற உலோக அயனிகளை நீக்கும் என்பதால் ஊன்பசை சேர்க்கப்படுகிறது. Cu2+ உலோக அயனி வினையூக்கியாகச் செயல்பட்டு ஐதரசீனை சிதைக்கிறது, குளோரமீனுடன் (NH2Cl) வினைபுரிந்து அமோனியம் குளோரைடையும் நைட்ரசனையும் உற்பத்தி செய்கிறது.
1890 ஆம் ஆண்டு நீரிய ஐதரசீனை நைட்ரசு அமிலம் மூலமாக ஆக்சிசனேற்றம் செய்து முதன்முதலில் ஐதரசன் அசைடு தயாரிக்கப்பட்டது. இது வெடிக்கும் தன்மை கொண்ட சேர்மமாகும். நீர்த்த நிலையில் கூட இச்சேர்மம் அபாயகரமானது. தாங்க முடியாத எரிச்சலூட்டும் மணமும் கொல்லும் நச்சுத்தன்மையும் இதன் குணங்களாகும். அசைடு எதிர்மின் அயனியின் இணை அமிலமாக கருதப்படும் ஐதரசன் அசைடு, ஐதரோ ஆலிக் அமிலத்துடன் ஒப்புமை கொண்டுள்ளது [42].
ஆலைடுகளும் ஆக்சோஆலைடுகளும்
[தொகு]
நைட்ரசனின் நான்கு எளிய டிரை ஆலைடுகள், சில கலப்பு ஆலைடுகள், சில ஐதரோ ஆலைடுகள் அறியப்படுகின்றன. ஆனால் இவை நிலைப்புத்தன்மை இல்லாமலும் அதிக பயன்பாடு இல்லாமலும் உள்ளன. உதாரணங்கள்: NClF2, NCl2F, NBrF2, NF2H, NCl2H, மற்றும் NClH2.
ஐந்து நைட்ரசன் புளோரைடுகள் அறியப்படுகின்றன. நைட்ரசன் டிரைபுளோரைடு (NF3) , முதன் முதலில் 1928 ஆம் ஆண்டில் தயாரிக்கப்பட்டது ஒரு நிறமற்ற மற்றும் மணமற்ற சேர்மமான இது வெப்பமண்டலியல் ரீதியாக நிலைப்புத் தன்மை உடையது. நீரற்ற ஐதரசன் புளோரைடில் கரைந்த உருகிய அமோனியம் புளோரைடை மின்னாற்பகுத்தல் மூலம் நைட்ரசன் டிரைபுளோரைடு தயாரிக்கலாம். கார்பன் டெட்ராபுளோரைடு போல இச்சேர்மம் வினைத்திறன் மிக்கது அல்ல.சூடுபடுத்தும்போது மட்டும் இது புளோரினேற்றும் முகவராகச் செயல்படுகிறது. தாமிரம், ஆர்சனிக், ஆண்டிமனி மற்றும் பிசுமத் ஆகிய தனிமங்களுடன் வினைபுரிகிறது. நைட்ரசன் டிரை புளோரைடில் இருந்து உயர் வெப்பநிலைகளில் டெட்ரா புளோரோ ஐதரசீனை (N2F4) தயாரிக்க இயலும். NF+4 மற்றும் N2F+3 போன்ற நேர்மின் அயனிகளும் அறியப்படுகின்றன. டெட்ரா புளோரோ ஐதரசீனை ஆர்சனிக் பென்டாபுளோரைடு போன்ற வலிமையான புளோரைடு ஏற்பிகளுடன் சேர்த்து N2F+3 நேர்மின் அயனி தயாரிக்கப்படுகிறது. குறுகிய N-O பிணைப்பு இடைவெளி, மறைமுகமாக உணர்த்தப்படும் இரட்டைப்பிணைப்பு, உயர் முனைவுத்திறன் போன்ற காரணங்களால் ONF3 சேர்மம் கவனம் பெறுகிறது. ஐதரசீனைப் போல அல்லாமல் டெட்ரா புளோரோ ஐதரசீன் அறை வெப்பநிலையில் பிரிகையடைந்து NF2• இயங்குறுப்பைக் கொடுக்கிறது. புளோரின் அசைடு (FN3) வெப்பவியல் ரீதியாக நிலைப்புத்தன்மையற்ற வெடிபொருளாகும். வெப்பவியல் ரீதியாக உள்ளிடை மாற்றம் மூலம் டைநைட்ரசன் டைபுளோரைடை சிசு, டிரான்சு எனப்படும் ஒருபக்க மாற்றியம் மற்றும் மறுபக்க மாற்றியங்களாக மாற்ற இயலும். FN3. சேர்மத்தின் வெப்பச்சிதைவு வினையில் இவ்விளைபொருள் அறியப்பட்டது [44].
நைட்ரசன் டிரைகுளோரைடு (NCl3) என்பது ஒரு அடர்த்தியான, ஆவியாகக்கூடிய, ஒரு வெடிக்கும் திரவமாகும், இதன் இயற்பியற் பண்புகள் கார்பன் டெட்ராகுளோரைடு|கார்பன் டெட்ராகுளோரைடின்]] பண்புகளை ஒத்திருக்கிறது. இவ்விரண்டுக்கும் இடையிலான ஒரே ஒரு வித்தியாசம் NCl3 சேர்மமானது நீர் மூலம் எளிமையாக நீராற்பகுக்கப்படுகிறது. ஆனால் CCl4 நீராற்பகுக்கப்பு அடைவதில்லை. பியர்ரி இலூயிசு டியுலாங்கு என்பவரால் இது முதலில் தொகுக்கப்பட்டது. இவ்வினையின்போது இச்சேர்மத்தின் வெடிக்கும் இயல்பால் டியுலாங்கு தன்னுடைய மூன்று விரல்களையும் ஒரு கண்ணையும் இழந்தார். நீர்த்தநிலை வாயுவாக இதுவொரு அபாயமற்ற சேர்மம் ஆகும். வெளுப்பானாகவும் நுண்ணுயிரகற்றியாகவும் இதைப் பயன்படுத்துகிறார்கள். நைட்ரசன் முப்புரோமைடு முதலில் 1975 இல் ஆழ்ந்த சிவப்பு நிறத்தில் வெப்பநிலை உணரியாக ஆவியாகும் திண்மமாக கண்டறியப்பட்டது. −100 °செல்சியசு வெப்பநிலையில் கூட இது வெடிக்கும் இயல்புடையது ஆகும். நிலைப்புத்தன்மையற்ற நைட்ரசன் டிரை அயோடைடு 1990 இல் கண்டறியப்பட்டது. சிறகு, காற்றோட்டம், ஆல்பா துகள்கள் [44][45] போன்ற சிறு அதிர்ச்சிகளையும் உணரவல்ல ஓர் உணரியான, அமோனியாவுடனான இதன் கூட்டுப்பொருள் முன்னரே அறியப்பட்டது. இக்காரணத்தால் மந்திர வேதியியல் என்ற நோக்கத்தில், சிலசமயங்களில் சிறிதளவு நைட்ரசன் டிரை அயோடைடு பள்ளிகளின் வகுப்பறைகளில் தயாரிக்கப்படுவதுண்டு [46].
நைட்ரோசில் ஆலைடுகள் (XNO) மற்றும் நைட்ரைல் ஆலைடுகள் (XNO2) என்ற இரண்டு வரிசைகளில் நைட்ரசன் ஆக்சோஆலைடுகள் அறியப்படுகின்றன. நைட்ரசு ஆக்சைடை நேரடியாக ஆலசனேற்றம் செய்வதன் மூலம் வினைத்திறன் மிக்க நைட்ரோசில் ஆலைடுகளை தயாரிக்கிறார்கள். நைட்ரோசில் புளோரைடு (NOF) நிறமற்றதாகவும் ஒரு தீவிர புளோரினேற்றும் முகவராகவும் காணப்படுகிறது. நைட்ரோசில் குளோரைடும் (NOCl) இதே பண்புகளைக் கொண்டு ஒரு கரைப்பானாகப் பயன்படுத்தப்படுகிறது. நைட்ரோசில் புரோமைடு (NOBr) சிவப்பு நிறத்திலுள்ள ஒரு சேர்மமாகும். நைட்ரைல் ஆலைடுகளின் வேதியியல் வினைகள் யாவும் ஒரே மாதிரியானவையாகும். நைட்ரைல் புளோரைடும் (FNO2), நைட்ரைல் குளோரைடும் ClNO2) வினைத்திறன் மிக்க வாயுக்களாகவும் தீவிர ஆலசனேற்ற முகவர்களாகவும் உள்ளன [44].
ஆக்சைடுகள்
[தொகு]
2 நிறமற்ற (N
2O
4), டைநைட்ரசன் டெட்ராக்சைடாக மாறுகிறது. உயர் வெப்பநிலைகளில் இது NO
2 ஆக மீள்கிறது.
நைதரசன் ஆக்சைடு அல்லது நாக்சு என்பது பொதுவாக நைட்ரசனும் ஆக்சிசனும் சேர்ந்து உருவாகும் நைட்ரசனின் ஆக்சைடு சேர்மங்களாகும். குறிப்பாக ஒரு நைட்ரசன் மூலக்கூறும் ஒன்றோ அல்லது இரண்டோ ஆக்சிசன் மூலக்கூறுகளும் சேர்ந்து உருவாகும் நைட்ரிக் ஆக்சைடு (NO) அல்லது நைட்ரசன் டை-ஆக்சைடு (NO2) என்னும் வேதிச்சேர்மங்களே நாக்சு என்று அழைக்கப்படுகின்றன. இவை எரிப்புச் செயல்முறைகளில் அதிலும் குறிப்பாக உயர்வெப்ப எரிப்புக்களின் போது உருவாகின்றன.
N2O (நைட்ரசு ஆக்சைடு), NO (நைட்ரிக் ஆக்சைடு), N2O3 (டைநைட்ரசன் டிரையாக்சைடு), NO2 (நைட்ரசன் டையாக்சைடு), N2O4 (டைநைட்ரசன் டெட்ராக்சைடு), N2O5 (டைநைட்ரசன் பென்டாக்சைடு), NO3(நைட்ரசன் டிரையாக்சைடு), N4O (நைட்ரோசிலசைடு) [47], மற்றும் N(NO2)3 (டிரைநைட்ரமைடு) [48]. முதலிய ஒன்பது வகையான மூலக்கூற்று ஆக்சைடுகளாக நைட்ரசன் உருவாகிறது. வெப்பவியல் ரீதியாக இவை அனைத்தும் நிலைப்புத்தன்மை அற்றவையாக உள்ளன. சாத்தியமுள்ளதாக அறியப்படும் ஆக்சாடெட்ரசோல் என்ற அரோமாட்டிக் வளைய ஆக்சைடு (N4O) இதுவரையில் தயாரிக்கப்படவில்லை[47].
சிரிப்பூட்டும் வாயு என்று அழைக்கப்படும் நைட்ரசு ஆக்சைடு (N2O), 250° செல்சியசு வெப்பநிலையில் உருகிய அமோனியம் நைட்ரேட்டை வெப்பச்சிதைவுக்கு உட்படுத்தி தயாரிக்கப்படுகிறது. இவ்வேற்ற ஒடுக்க வினையில் நைட்ரிக் ஆக்சைடும், நைட்ரசனும் உடன் விளைபொருட்களாக விளைகின்றன. பெரும்பாலும் உந்து எரிபொருளாகவும் காற்றேற்ற முகவராகவும் இது பயன்படுத்தப்படுகிறது. முற்காலத்தில் இதை மயக்கமூட்டியாகவும் பயன்படுத்தினர். தோற்றம் ஒரே மாதிரியாக இருந்த போதிலும், இதை ஐப்போ நைட்ரசு அமிலத்தின் (H2N2O2) நீரிலி என்று கருதமுடியாது. ஏனெனில் அது நைட்ரசு ஆக்சைடை நீரில் கரைத்தலால் உருவாக்கப்படவில்லை. இது ஆலசன்கள், கார உலோகங்கள், அல்லது அறை வெப்பநிலையில் ஓசோன் (சூடாக்கலின்போது வினைத்திறன் அதிகரிக்கிறது), முதலானவற்றுடன் வினைபுரிவதில்லை. 600 ° செல்சியசு வெப்பநிலைக்கு மேல் இது சமச்சீர்மையற்ற N–N–O (N≡N+O−↔−N=N+=O) கட்டமைப்பைப் பெற்றுள்ளது. பலவீனமான N-O பிணைப்பை உடைப்பதன் மூலம் இது பிரிகையடைகிறது [47].
நைட்ரிக் ஆக்சைடு (NO) என்பது குறைந்தபட்ச சிக்கல் கொண்ட ஒரு மூலக்கூறு ஆகும், இச்சேர்மத்தில் ஒற்றைப்படை எலக்ட்ரான்களின் எண்ணிக்கை நிலையாக உள்ளது. மனிதர்கள் உட்பட பாலூட்டிகளில், இச்சேர்மம் பல உடலியல் மற்றும் நோயியல் செயல்முறைகளில் ஈடுபடுகின்ற ஒரு முக்கியமான செல்லிடை சமிக்ஞை மூலக்கூறு ஆகும் [49]. அமோனியாவை ஒரு வினையூக்கியின் முன்னிலையில் ஆக்சிசனேற்றம் செய்தால் நைட்ரிக் ஆக்சைடு உருவாகிறது. இணைகாந்த வளிமமான இச்சேர்மம் நிறமற்றும் வெப்பவியல் ரீதியாக நிலைத்தன்மை அற்றும் காணப்படுகிறது. 1100–1200 ° செல்சியசு வெப்பநிலையில் நைட்ரசன் மற்றும் ஆக்சிசனாக இச்சேர்மம் சிதைவடைகிறது. நைட்ரசனில் உள்ளது போலவே பிணைப்பு இருந்தாலும் ஒரு கூடுதல் எலக்ட்ரான் π* பிணைப்பெதிர் ஆர்பிட்டாலுடன் இணைகிறது. இதனால் பிணைப்பு நிலை தோராயமாக 2.5 குறைகிறது.
நீல டைநைட்ரசன் டிரையாக்சைடு (N2O3) திண்மநிலையில் மட்டுமே கிடைக்கிறது. ஏனெனில் இதனுடைய உருகு நிலைக்கு மேலான வெப்பநிலைகளில் உடனடியாகச் பிரிகை அடைந்து நைட்ரிக் ஆக்சைடு, நைட்ரசன் டை ஆக்சைடு (NO2) மற்றும் டைநைட்ரசன் டெட்ராக்சைடு (N2O4) ஆகியவற்றைக் கொடுக்கிறது. நைட்ரசன் டை ஆக்சைடு மற்றும் டைநைட்ரசன் டெட்ராக்சைடு இரண்டுக்கும் இடையே நிலவும் சமநிலை காரணமாக இவற்றை தனித்தனியே ஆய்வு செய்வது கடினமாகும். சிலநேரங்களில் டைநைட்ரசன் டெட்ராக்சைடு சேர்மம் ஓர் ஊடகத்தில் உயர் மின்கடத்தா மாறிலி அளவுடன் சமமற்ற பிளவு வினையினால் நைட்ரசோனியம் மற்றும் நைட்ரேட்டுகளைக் கொடுக்கிறது. விரும்பத்தகாத கார மணத்துடன் பழுப்பு நிறங்கொண்டு அரிக்கும் பண்பு கொண்ட வளிமமாக நைட்ரசன் டையாக்சைடு காணப்படுகிறது. உலர் உலோக நைட்ரேட்டை சிதைவு வினைக்கு உட்படுத்துவதன் மூலம் இவ்விரண்டு சேர்மங்களையும் எளிமையாகத் தயாரிக்க முடியும். இரண்டும் தண்ணீருட வினைபுரிந்து நைட்ரிக் அமிலத்தைக் கொடுக்கின்றன. நீரற்ற உலோக நைட்ரேட்டுகளையும் நைட்ரேட்டோ அணைவுச் சேர்மங்களையும் தயாரிப்பதற்கு டைநைட்ரசன் டெட்ராக்சைடு மிகவும் பயனுள்ளதாக உள்ளது. 1950 களில் அமெரிக்கா மற்றும் உருசியாவில் பல இராக்கெட்டுகளுக்கான ஆக்சிசனேற்றியாக தேர்வு செய்யப்பட்டு சேமித்து வைக்கபட்டது. ஏனெனில் அறை வெப்பநிலையில் இது நீர்மமாகக் காணப்படுகிறது. உடனடி தீப்பற்று எரிபொருளான இதை ஐதரசீனுடன் சேர்த்து இராக்கெட் எரிபொருளாக சேமிக்க இயலும் [47].
வெப்பவியல் ரீதியாக நிலையற்றதாகக் கருதப்படும் அதி தீவிர டைநைட்ரசன் பென்டாக்சைடு (N2O5) சேர்மம் நைட்ரிக் அமிலத்தின் நீரிலியாகும். நைட்ரிக் அமிலத்துடன் பாசுபரசு பென்டாக்சைடு சேர்த்து நீர்நீக்கம் செய்வதன் மூலமாக இதைத் தயாரிக்க முடியும். வெடிபொருட்கள் தயாரிக்க இதைப் பயன்படுத்துவார்கள். ஒரு நீருறிஞ்சியாக, நிறமற்ற படிகத் திண்மமாக, ஒளி உணரியாக டைநைட்ரசன் பென்டாக்சைடு காணப்படுகிறது. திண்மநிலையில் இதன் அயனிக் கட்டமைப்பு [NO2]+[NO3]− ஆகவும் வளிமநிலையிலும் கரைசலிலும் இதன் மூலக்கூற்று கட்டமைப்பு O2N–O–NO2 ஆகவும் உள்ளது. நீரேற்றம் செய்யும்போது இது பெராக்சோநைட்ரிக் அமிலத்தைக் (HOONO2) கொடுக்கிறது. மேலும் இதுவொரு தீவிர ஆக்சிசனேற்ற முகவராகும். வாயுநிலை டைநைட்ரசன் பென்டாக்சைடு கீழ்கண்டவாறு சிதைவடைகிறது :[47]
- N2O5
 NO2 + NO3 → NO2 + O2 + NO
NO2 + NO3 → NO2 + O2 + NO - N2O5 + NO
 3 NO2.
3 NO2.
எனவே விதிவிலக்காக, கொதிநிலைக்கு கீழான வெப்பநிலையில் O=N–N=O பிணைப்புக்கு இருபடியாக்கல் பொருந்துவதில்லை. (இங்கு ஒருபக்க மாற்றியம் நிலைப்புத் தன்மையுடன் உள்ளது) ஏனெனில் ஒட்டு மொத்த பிணைப்பு நிலையை இது உயர்த்துவதில்லை. இணையில்ல எலக்ட்ரான் NO மூலக்கூறுக்கு குறுக்காக உள்ளடங்காமல் நிலைப்புத்தன்மையைக் கொடுக்கிறது. நைட்ரிக் ஆக்சைடு துருவ மூலக்கூறுகளுடன் ஒடுக்கப்படும் போது, சமச்சீரற்ற சிவப்பு இருபடி O = N-O = N க்கான சான்றுகளும் உள்ளன. நைட்ரிக் ஆக்சைடு ஆக்சிசனுடன் வினைபுரிந்து பழுப்பு நிற நைட்ரசன் டை ஆக்சைடையும், ஆலசன்களுடன் வினைபுரிந்து நைட்ரோசில் ஆலைடுகளையும் தருகிறது. இடைநிலை உலோகச் சேர்மங்களுடன் வினைபுரிந்து ஆழ்ந்த நிறமுடைய நைட்ரோசில் அணைவுச் சேர்மங்களைக் கொடுக்கிறது [47].
ஆக்சோ அமிலங்கள், ஆக்சோ எதிர்மின்னயனிகள், ஆக்சோ அமிலவுப்புகள்
[தொகு]பல நைட்ரசன் ஆக்சோ அமிலங்கள் அறியப்பட்டுள்ளன. நீரிய கரைசல் அல்லது உப்புகளாக அறியப்படும் இவற்றில் பெரும்பாலானவை தூய்மையான நிலையில் நிலைப்புத்தன்மை அற்றவையாகும். பலவீனமான இரட்டைப் புரோட்டான் அமிலமாகக் கருதப்படும் ஐப்போநைட்ரசு அமிலம் (H2N2O2), HON=NOH என்ற கட்டமைப்பைக் கொண்டுள்ளது. (காடித்தன்மை எண் pKa1 6.9, pKa2 11.6) அமிலக் கரைசல்கள் நிலைப்புத்தன்மை கொண்டுள்ளன. ஆனால் pH 4 கார வினையூக்கச் சிதைவு [HONNO]−என்ற அயனி வழியாக நிகழ்கிறது. நைட்ரசு ஆக்சைடும் ஐதராக்சைடு எதிர்மின் அயனியும் தோன்றுகின்றன. N2O2−2 எதிர்மின் அயனிகள் பங்குபெறும் ஐப்போநைட்ரைட்டுகள் நிலைப்புத்தன்மை கொண்டவையாக உள்ளன. பொதுவாக ஒடுக்கும் முகவர்களாகவும் இவை செயற்படுகின்றன. நைட்ரசன் சுழற்சியில் அமோனியாவிலிருந்து நைட்ரைட்டு தோன்றும் பொழுது இடைநிலை படிநிலையாக இது தோன்றுகிறது. ஐப்போநைட்ரைட்டு ஓர் இணைக்கும் அல்லது நச்சேற்றும் இருபல் ஈனியாகவும் செயற்படுகிறது.
ஒரு தூய்மையான சேர்மமாக நைட்ரசு அமிலம் (HNO2) இருப்பதில்லை. ஆனால் வாயுச் சமநிலையில் இதுவொரு முக்கியமான நீரிய வினைப்பொருளாகக் கருதப்படுகிறது. குளிர்ந்த நீரிய நைட்ரைட்டு கரைசல்களை அமிலமாக்கல் மூலம் நைட்ரசு அமிலத்தின் நீர்த்த கரைசல்களை தயாரிக்க முடியும். அறை வெப்பநிலையில் ஏற்கனவே நைட்ரேட்டாகவும், நைட்ரிக் ஆக்சைடாகவும் கணிசமாக புரோட்டான் நீக்கம் செய்யப்பட்டுள்ளது. 18 ° செல்சியசு வெப்பநிலையில் காடித்தன்மை எண் 3.35 என்ற மதிப்பைக் கொண்டிருக்கும் ஓர் பலவீனமான அமிலமாக நைட்ரசு அமிலம் கருதப்படுகிறது.
பெர்மாங்கனேட்டைப் பயன்படுத்தி நைட்ரேட்டாக ஆக்சிசனேற்றம் அடைவதை தரம்பார்த்தல் சோதனையின் மூலமாக சோதிக்கமுடியும். கந்தக டை ஆக்சைடைக் கொண்டு நைட்ரசு மற்றும் நைட்ரிக் ஆக்சைடுகளாக இதை ஒடுக்கமுடியும். வெள்ளீயம்(II) உடன் சேர்த்து ஐப்போ நைட்ரசு அமிலமாகவும் ஐதரசன் சல்பைடைச் சேர்த்து அமோனியாவாகவும் இதை ஒடுக்கலாம். ஐதரசோனியம் உப்புகள் N2H+ 5 நைட்ரசு அமிலத்துடன் வினைபுரிந்து அசைடுகளையும், மேலும் இவை தொடர்ந்து வினைபுரிந்து நைட்ரசு ஆக்சைடையும் நைட்ரசனையும் தருகின்றன. 100 மி.கி/கி,கி க்கு அதிகமான அளவுகளில் சோடியம் நைட்ரைட்டு ஒரு மிதமான நச்சுத்தன்மையை வெளிப்படுத்துகிறது. ஆனாலும் சிறிய அளவுகளில் இதை கறியைப் பதப்படுத்தவும் பாதுகாக்கவும் பயன்படுத்துகிறார்கள். மேலும் இதை ஐதராக்சிலமீன் தயாரிக்கவும், முதல்நிலை அரோமாட்டிக் அமீன்களை ஈரசோ ஆக்கம் செய்யவும் பயன்படுத்துகிறார்கள். இதற்கான சமன்பாடு இங்கு தரப்பட்டுள்ளது :[50]
- ArNH2 + HNO2 → [ArNN]Cl + 2 H2O.
நைட்ரைட்டு ஒரு பொதுவான ஈனியாகும். இது ஐந்து வகையான ஒருங்கிணைவுகளைக் கொடுக்கிறது. நைட்ரசனில் இருந்து பிணைக்கப்படும் நைட்ரோ ஒருங்கினைப்பு, ஆக்சிசனில் இருந்து பிணைக்கப்படும் நைட்ரிட்டோ ஒருங்கிணைப்பு இரண்டும் மிகப்பொதுவானவையாகும். நைட்ரோ-நைட்ரிட்டோ மாற்றியமும் பொதுவானதாகும். இங்கு நைட்ரிட்டோ வடிவம் வழக்கமாக நிலைப்புத்தன்மை குறைவானதாகும் [50].

நைட்ரசனின் ஆக்சோ அமிலங்களில் மிக முக்கியமானதும் நிலையானதுமான அமிலம் நைட்ரிக் அமிலம் (HNO3) ஆகும். கந்தக அமிலம், ஐதரோகுளோரிக் அமிலங்களின் வரிசையில் அதிகமாக பயன்படக்கூடிய அமிலமாக நைட்ரிக் அமிலம் உள்ளது. 13 ஆம் நூற்றாண்டில் இரசவாதிகளால் இவ்வமிலம் கண்டறியப்பட்டது. அமோனியாவை ஒரு வினையூக்கியின் உதவியால் ஆக்சிசனேற்றம் செய்து நைட்ரிக் ஆக்சைடு தயாரிக்கப்படுகிறது. இதை மீண்டும் ஆக்சிசனேற்றம் செய்து நைட்ரசன் டையாக்சைடு உருவாக்கி இதை தண்ணீரில் கரைத்தால் அடர் நைட்ரிக் அமிலம் உருவாகிறது. அமெரிக்காவில் ஒவ்வொரு ஆண்டும் ஏழு மில்லியன் டன் நைட்ரிக் அமிலம் உற்பத்தி செய்யப்படுகிறது, அவற்றில் பெரும்பகுதி நைட்ரேட் உற்பத்திக்காகவும் உரங்கள் மற்றும் வெடிபொருட்கள் தயாரிக்கவும் பயன்படுத்தப்படுகின்றன. அடர் நைட்ரிக் அமிலத்தை பாசுபரசு பென்டாக்சைடைச் சேர்த்து தாழ் அழுத்தத்தில் கண்ணாடி உபகரணத்தில் ஒளிபுகா சூழலில் வாலை வடித்து நீரற்ற நைட்ரிக் அமிலம் தயாரிக்கப்படுகிறது. திண்மநிலையில் மட்டுமே இதைத் தயாரிக்க முடியும். ஏனெனில் சூடுபடுத்தினால் உருகுநிலையில் இது தற்சிதைவு அடைந்து நைட்ரசன் டையாக்சைடாக மாறிவிடும். மேலும், நீர்மநிலை நைட்ரிக் அமிலம் பிற சகப்பிணைப்பு நீர்மங்களைக் காட்டிலும் பெருமளவில் தன்னயனியாக்கம் அடைகிறது [50]
- 2 HNO3
 H
H
2NO+
3 + NO−
3 H2O + [NO2]+ + [NO3]−.
H2O + [NO2]+ + [NO3]−.
உலோகத்தின் காரத்தன்மையைப் பொறுத்தே நைட்ரேட்டுகளின் (முக்கோணத் தளத்தில் பங்கேற்கும் NO−3 எதிர் மின்னயனி) வெப்பரீதியான நிலைப்புத்தன்மை அமைகிறது. வெப்பச்சிதைவால் உருவாகும் விளைபொருட்களும் வேறுபடுகின்றன. நைட்ரேட்டு ஒரு பொதுவான ஈனியாக வெவ்வேறு வகை ஒருங்கிணைவுகளைக் கொண்டுள்ளது [50].
ஆர்த்தோ பாசுபாரிக் அமிலத்தை ஒத்த ஆர்த்தோநைட்ரிக் அமிலம் (H3NO4) ஏதும் அறியப்படவில்லை. நான்முக ஆர்த்தோநைட்ரேட்டு எதிர்மின் அயனி சோடியம் , பொட்டாசியம் உப்பகளில் அறியப்படுகிறது :[50]
- .
வெண்மையான இப்படிக உப்புகள் காற்றிலுள்ள நீராவி மற்றும் கார்பனீராக்சைடு போன்றவற்றுக்கு தீவிர உணரிகளாக உள்ளன :[50]
- Na3NO4 + H2O + CO2 → NaNO3 + NaOH + NaHCO3.
ஆர்த்தோ நைட்ரேட்டு எதிர்மின் அயனி குறைவான வேதியியலை கொண்டிருந்த போதிலும், அதன் வழக்கமான நான்முக வடிவம் மற்றும் குறுகிய N-O பிணைப்பு நீளங்கள் , பிணைப்பில் வெளிப்படுத்தும் குறிப்பிடத்தக்க முனைவுப் பண்புகள் ஆகியவற்றின் காரணமாக கட்டமைப்புக் கண்ணோட்டத்தில் சிறந்து விளங்குகிறது [50].
கரிம நைட்ரசன் சேர்மங்கள்
[தொகு]கரிம வேதியியலில் பயன்படும் முக்கியமான தனிமங்களில் ஒன்று நைட்ரசன் ஆகும். பல வேதி வினைக்குழுக்களில் கார்பன்–நைட்ரசன் பிணைப்பு பங்கேற்கிறது. அமைடுகள் (RCONR2), அமீன்கள் (R3N), இமைன்கள் (RC(=NR)R), இமைடுகள் (RCO)2NR, அசைடுகள் (RN3), அசோ சேர்மங்கள் (RN2R), சயனேட்டுகள் (ROCN, ஐசோசயனேட்டுகள் (RCNO), நைட்ரேட்டுகள் (RONO2), நைட்ரைல்கள் (RCN), ஐசோநைட்ரைல்கள் (RNC), நைட்ரைட்டுகள் (RONO), நைட்ரோ சேர்மங்கள் (RNO2), நைட்ரோசோ சேர்மங்கள் (RNO), ஆக்சைம்கள் (RCR=NOH) மற்றும் பிரிடின் வழிப்பொருட்கள் உள்ளிட்டவை இதற்கு உதாரணங்களாகும். C–N பிணைப்புகளில் முனைவுத்தன்மை நைட்ரசனை நோக்கி வலிமையாக உள்ளன. இவ்வகைச் சேர்மங்களில் வழக்கமாக நைட்ரசன் முப்பிணைப்பு கொண்டுள்ளது. (அமோனியம் உப்புகளில் நான்கு இணைதிறன்) ஒரு தனி இணை எலக்ட்ரான் புரோட்டானுடன் ஒருங்கிணைந்து காரத்தன்மைக்கு காரணமாகிறது மற்றும் மற்ற காரணிகளைப் பாதிக்கிறது. உதாரணமாக அமைடுகள் காரத்தன்மை கொண்டிருக்கவில்லை. ஏனெனில் தனி இணை எலக்ட்ரான் இரட்டைப்பிணைப்புக்குள் உள்ளடங்குவதில்லை. (தாழ் pH, மதிப்புகளில் ஆக்சிசனில் புரோட்டானேற்றம் நிகழ்ந்து அமிலமாகவும் இவை செயல்படலாம்). பிர்ரோல் அமிலத்தன்மையைக் காட்டவில்லை. ஏனெனில் தனி இணை எலக்ட்ரான் அரோமாட்டிக் வளையத்தில் உள்ளடங்குவதில்லை [51]. ஒரு வேதிப்பொருளில் உள்ள நைட்ரசனின் அளவை யோகன் குசுதாவ் உருவாக்கிய ஒரு முறையில் கணடறியலாம் [52]. உட்கரு அமிலங்களிலும், புரதங்களிலும், அமினோ அமிலங்களிலும் அடினோசின் முப்பாசுப்பேட்டிலும் நைட்ரசன் முக்கியப்பகுதிப் பொருளாக காணப்படுகிறது [51].
தோற்றம்
[தொகு]
பூமியில் காணப்படும் மிகவும் தூய்மையான தனிமங்களில் ஒன்று நைட்ரசன் ஆகும், நைட்ரசன் வளிமண்டலத்தின் முழு அளவில் 78.1% அளவைக் கொண்டுள்ளது[1]. இதைத்தவிர புவியோட்டில் பரவலாக நைட்ரசன் காணப்படவில்லை. நையோபியம், காலியம், இலித்தியம் ஆகிய தனிமங்களுடன் ஒப்பிடுகையில் ஒரு மில்லியனுக்கு 19 பாகங்கள் அளவே நைட்ரசன் காணப்படுகிறது. நைட்ரசனின் முக்கியமான தாதுக்கள் நைட்டர் (பொட்டாசியம் நைட்ரேட், சால்ட்பீட்டர்) மற்றும் சோடாநைட்டர் (சோடியம் நைட்ரேட், சிலியன் சால்ட்பீட்டர்) ஆகியவை மட்டுமேயாகும். இருப்பினும், 1920 ஆம் ஆண்டுகளில் அம்மோனியா மற்றும் நைட்ரிக் அமிலத்தின் வழியாக தொழிற்துறைத் தயாரிப்பு பொதுவாக மாறும்வரை இத் தாதுக்கள் முக்கியமான தாதுக்களாக கருதப்படவில்லை [53].
நைட்ரசன் சேர்மங்கள் தொடர்ந்து வளிமண்டலத்திற்கும் உயிரினங்களுக்கும் இடையில் பரிமாறிக்கொள்ளப்படுகின்றன. வளி மண்டலத்தில் உள்ள நைட்ரசனை தாவரங்கள் பயன்படுத்திக் கொள்ளும் வகையில் அதாவது அமோனியாவாக முதலில் நிலை நிறுத்தப்படவேண்டும். மின்னல் போன்ற இயற்கைச் செயல்முறைகளால் நைட்ரசன் ஆக்சைடுகள் உருவாக்கப்பட்டு சிறிதளவு நைட்ரசன் நிலைநிறுத்தப்படுகிறது. ஆனால் பெரும்பாலான நைட்ரசன், நைட்ரோசனேசுகள் எனப்படும் நொதிகளின் உதவியுடன் நிலைநிறுத்தும் பாக்டீரியாக்களால் நிலைநிறுத்தப்படுகின்றன. நிலைநிறுத்தப்பட்ட அமோனியாவை தாவரங்கள் எடுத்துக் கொண்டவுடன் அவை புரோட்டீன் தயாரிப்பில் ஈடுபடுகின்றன. இத்தாவரங்களை உண்ணும் விலங்குகளில் இவை செரிக்கப்பட்டு நைட்ரசன் கொண்ட கழிவுகளாக வெளியேற்றப்படுகின்றன. இறுதியாக இவ்வுயிரினங்களும் மடிந்து மண்னில் புதைந்து சிதைவடைகின்றன. பாக்டீரியாக்களாலும் வளிமண்டல ஆக்சிசனேற்ற வினைகளாலும் இவற்றிலிருந்து நைட்ரசன் நீக்கவினை நிகழ்கிறது. நைட்ரசன் மீண்டும் வளிமண்டலத்தில் விடப்படுகிறது. ஏபர் செயல்முறை மூலம் தொழில்துறையில் நைட்ரசன் நிலைப்படுத்தப்படுகிறது. பெரும்பாலும் இந்நைட்ரசன் உரமாக பயன்படுத்தப்படுகிறது. தூயநீரில் சேரும் நைட்ரசன் தாங்கிய கழிவுப்பொருட்களால் ஆக்சிசன் குறைபாடு தோன்றி உயர் உயிரினங்கள் இறக்கின்றன. நைட்ரசன் நீக்கத்தின் போது உருவாகும் நைட்ரசு ஆக்சைடு வளிமண்டல ஓசோன் அடுக்குகளைத் தாக்குகிறது [53].
பல உப்புநீர் தயாரிப்பாளர்கள் சுற்றுச்சூழலின் சவ்வூடுபரவல்; விளைவுகளிலிருந்து மீன்களைக் காப்பாற்ற அதிக அளவிலான டிரைமெத்திலமீன் ஆக்சைடை தயாரிக்கின்றனர். இச்சேர்மம் டைமெத்திலமீனாக மாற்றப்படுதலே தூய்மையற்ற உப்புநீர் மீன்களின் நாற்றத்திற்கு காரணமாகும் [54]. விலங்கினங்களில் அமினோ அமிலங்களில் இருந்து வருவிக்கப்படும் தனி உறுப்பு நைட்ரிக் ஆக்சைடு சுழற்சியை முறைப்படுத்தும் ஒரு முக்கியமான மூலக்கூறு ஆகும் [55].
நைட்ரிக் ஆக்சைடு தண்ணீருடன் புரியும் விரைவு வினை விலங்குகளில் வளர்சிதை மாற்ற நைட்ரைட்டை உற்பத்தி செய்வதில் முடிகிறது.
புரோட்டீன்களில் உள்ள நைட்ரசன் விலங்குளில் நிகழும் வளர்சிதை மாற்றத்தால், பொதுவாக, யூரியாவாக வெளியேறுகிறது. அதே நேரத்தில் நியூக்ளிக் அமிலங்கள் விலங்கு வளர்சிதை மாற்றத்தில் யூரியா மற்றும் யூரிக் அமிலமாக வெளியேறுகின்றன. விலங்குகளின் மாமிச சிதைவின் குணாதிசயமான துர்நாற்றம், புட்ரோரெசின் மற்றும் காடவெரைன் போன்ற நீண்ட சங்கிலி, நைட்ரசனைக் கொண்ட அமீன்கள் உற்பத்தி செய்யப்படுவதால் உண்டாகிறது, இந்நீண்ட சங்கிலி அமீன்கள் முறையே ஆர்னிதைன் மற்றும் லைசின் போன்ற அமினோ அமிலங்கள் சிதைவதால் விளைகின்றன [56].
உற்பத்தி
[தொகு]வர்த்தக ரீதியிலான நைட்ரசன் எஃகு தொழிற்சாலைகளில் உடன் விளை பொருளாக உருவாகிறது. உருளைகளில் ஆக்சிசனற்ற நைட்ரசன் என்ற பெயரில் வினியோகிக்கப்படுகிறது.
காற்றை நீர்மமாக்கி அதிலிருந்து தொழிற்சாலை வாயுவான நைட்ரசன் நீர்மத்தைக் காய்ச்சி வடித்தல் மூலம் பெறுகின்றார்கள். நீர்மக் காற்றை கொஞ்சம் கொஞ்சமாகச் சூடுபடுத்தி, வெவ்வேறு கொதி நிலை உடைய வளிமங்களை ஆவியாக்கி குளிர்வித்து நீர்மமாக்கி செழுமையூட்டுவர். அல்லது வாயுநிலையில் உள்ள காற்றை இயங்கு கருவிகள் மூலம் தலைகீழ் சவ்வூடுபரவல் அல்லது அழுத்தம் மாறு பரப்பீர்ப்பு முறையில் தயாரிக்கப்படுகிறது [57]. வர்த்தக ரீதியிலான நைட்ரசன் எஃகு தொழிற்சாலைகளில் உடன் விளை பொருளாக உருவாகிறது. உருளைகளில் ஆக்சிசனற்ற நைட்ரசன் என்ற பெயரில் வினியோகிக்கப்படுகிறது [58]. வர்த்தக நைட்ரசனில் உள்ள ஆக்சிசனின் அளவு மில்லியனுக்கு 20 பகுதிகள் ஆகும். மில்லியனுக்கு 2 பகுதிகள் ஆக்சிசன் கொண்ட தரப்படுத்தப்பட்ட நைட்ரசன், மில்லியனுக்கு 10 பகுதிகள் ஆர்கான் கொண்ட நைட்ரசன் போன்ற வகைகளும் கிடைக்கின்றன [59]. நைட்ரசனின் கொதி நிலை - 195.8 டிகிரி C ஆகும். காற்று வெளியில் பொட்டாசியம் பைரோ காலேட்டை வைத்து அதிலுள்ள ஆக்சிஜன் மற்றும் கார்பன்டைஆக்சைடை நீக்கி நைட்ரசன் மட்டும் எஞ்சுமாறு செய்கின்றாகள். வளி மண்டலக் காற்றிலிருந்து பெறப்படும் நைட்ரசன் தூய்மையானதில்லை. ஏனெனில் அதில் மந்த வளிமங்களான ஆர்கான், கிரிப்டான் போன்றவை சிறிதளவு கலந்திருக்கும். எனவே தூய நைட்ரசன் பெற வேதியியல் வினைகளையே அணுக வேண்டியுள்ளது. செம்பையும் நைட்ரிக் அமிலத்தையும் சமவிகிதத்தில் கலந்து நைட்ரிக் ஆக்சைடு உற்பத்தி செய்கிறார்கள். பின்னர் இதை சூடுபடுத்தப்பட்ட செம்புத் துருவல்கள் வழியே செலுத்தி நைட்ரசனைத் தயாரிக்கிறார்கள்.
நீர்த்த அமோனியம் குளோரைடுடன் சோடியம் நைட்ரைட்டைச் சேர்த்து சூடுபடுத்தி ஆய்வகத்தில் நைட்ரசனை எளிதாகப் பெறலாம் [60]
- NH4Cl + NaNO2 → N2 + NaCl + 2 H2O.
இவ்வினையில் NO மற்றும் HNO3 போன்ற மாசுக்களும் உடன் விளைகின்றன. பொட்டாசியம் டைகுரோமேட்டு கலந்த நீர்த்த கந்தக அமிலத்தின் வழியாகச் செலுத்துவதால் இம்மாசுக்களை அகற்றலாம் [60] பேரியம் அசைடு அல்லது சோடியம் அசைடு சேர்மத்தை வெப்பச் சிதைவுக்கு உட்படுத்தி மீத்தூய நைட்ரசன் தயாரிக்கலாம்,[61]
- 2 NaN3 → 2 Na + 3 N2.
பயன்பாடுகள்
[தொகு]வாயு
[தொகு]நைட்ரசன் சேர்மங்களின் வகைப்பாடுகள் அதிக அளவில் உள்ளதால் இவற்றின் பயன்பாடுகளும் இயற்கையாகவே மிகவும் பரவலான அளவில் மாறுபடுகின்றன. எனவே தூய நைட்ரசனின் பயன்கள் மட்டுமே இங்கு பரிசீலிக்கப்படுகின்றன. தொழில் துறையில் உற்பத்தி செய்யப்படும் நைட்ரசனில் மூன்றில் இரண்டு பங்கு வாயுவாகும், மீதமுள்ள மூன்றில் ஒரு பங்கு திரவமாகவும் விற்கப்படுகின்றன. காற்றில் உள்ள ஆக்சிசன் தீ, வெடிப்பு, அல்லது ஆக்சிசனேற்ற அபாயத்தை ஏற்படுத்தும் போதெல்லாம் நைட்ரசன் வாயு பெரும்பாலும் மந்தநிலையான சூழலில் மட்டுமே பயன்படுத்தப்படுகிறது. சில உதாரணங்கள் பின்வருமாறு [59]:
- தூய அல்லது கார்பன் டை ஆக்சைடுடன் கலந்து நைட்ரசனேற்றம் செய்யவும், தொகுப்பு அல்லது மொத்தமாக உணவின் புத்துணர்வை தக்கவைத்து பராமரிக்க உதவும் மாற்றியமைக்கப்பட்ட ஒரு வளிமண்டலமாக பயன்படுத்தப்படுகிறது. மேலும் தூய நைட்ரசனை ஒரு உணவுக் கூட்டுப்பொருளாகக் கருதி ஐரோப்பிய ஒன்றியம் இதற்கு இ941 என்ற அடையாள எண்ணைக் கொடுத்துள்ளது [62].
- வெண்சுடர் எரிவிளக்குகளில் ஆர்கான் வாயுவுக்கு மாற்றாக நைட்ரசன் வாயு பயன்படுத்தப்படுகிறது.[63]
- தகவல் தொழில்நுட்பக் கருவிகளில் தீயடக்கியாக நைட்ரசன் வாயு பயன்படுத்தப்படுகிறது.[59]
- பெருமளவில் எஃகு தயாரிப்பில் நைட்ரசன் பயன்படுகிறது.[64]
- நைட்ரசனேற்றம் மூலம் எஃகை கடினப்படுத்துதலில் நைட்ரசன் வாயு பயன்படுகிறது.[65]
- சில வானூர்தி எரிபொருள் அமைப்புகளில் தீ விபத்துகளைக் குறைக்கஃ நைட்ரசன் வாயு பயன்படுகிறது.[66]
- பந்தய வாகனங்களின் சக்கரங்களையும் வானூர்திகளின் சக்கரங்களை நிரப்பவும் பயன்படுகிறது [67]
இரசாயன பகுப்பாய்வுக்கான மாதிரிகள் தயாரிப்பில் நைட்ரசன் பொதுவாக பயன்படுத்தப்படுகிறது. திரவ மாதிரிகளின் அடர்த்தியையும் கன அளவைவும் கூட்டுவதற்கும் குறைப்பதற்கும் நைட்ரசன் வாயு பயன்படுகிறது. திரவத்தின் மேற்பரப்புக்கு செங்குத்தாக அழுத்தத்திலுள்ள நைட்ரசன் வாயுக் கற்றையை செலுத்துவதால் கரைப்பான்கள் வெளியேறுகின்றன. ஆவியாக்கப்படாத கரைப்பானும் கரைபொருளும் அடியில் தேங்குகின்றன [68]. ஏல் போன்ற சில பியர் வகைகளில் நைட்ரசன் வாயுவை கார்பன் டை ஆக்சைடுடன் இணைத்து பயன்படுத்துகிறார்கள் [69]. அழுத்த உணரியாக விட்கெட் என்ற பெயரிலான நைட்ரசன் சேர்க்கப்பட்ட பியர்கள் புட்டிகளிலும் கலன்களிலும் அடைத்து விற்கப்படுகின்றன [70][71]. ஆற்றல் மூலங்களாகச் செயல்படும் கார்பன் டை ஆக்சைடை நைட்ரசன் தொட்டிகள் இடப்பெயர்ச்சி செய்து வருகின்றன [72]. நைட்ரசன் மூச்சுத்திணறலை உருவாக்கும் வாயுவாக கருதப்பட்டு கொல்லும் ஊசியாக உட்செலுத்தவும் பயன்பாடுகிறது[73][74]. சோடியம் அசைடிலிருந்து தயாரிக்கப்படும் நைட்ரசன் வாயுவை காற்றுப்பைகளில் நிரப்ப பயன்படுத்துகிறார்கள்[75].
நீர்ம நைட்ரஜன்
[தொகு]நீர்ம நைட்ரசன் உணவுப் பொருட்களின் குளிர்பதனப் பாதுகாப்புக்கும், உயிர் பொருட்களைப் பாதுகாத்துப் பிற்பாடு பயன்படுத்திக் கொள்வதற்கும் பயன்தருகிறது. எடுத்துக் காட்டாக மனிதர்கள் மற்றும் விலங்கினங்களின் விந்துக்களை நீர்ம நைட்ரசனில் முக்கி வைத்து பிற்பாடு செயற்கையாகக் கருத்தரித்தலுக்குப் பயன்படுத்திக் கொள்கின்றார்கள். மிகவும் தீவிரமாக வினையில் ஈடுபடக் கூடிய வளிமண்டல வளிமங்களிலிருந்து, அதனால் பாதிக்கப்படும் புதிய உற்பத்திப் பொருட்களை விலக்கி வைக்க நைட்ரஜன் வளிமத்தை மூடு திரையாகப் பயன்படுத்துகின்றார்கள்.
திரவ நைட்ரசன் ஒரு தாழ்வெப்ப திரவமாகும். தீவார் குடுவைகள் போன்ற முறையான கொள்கலன்களில் காக்கப்பட்டால் இது ஆவியாதல் இழப்பு இல்லாமல் கொண்டு செல்ல முடியும்[76].
பிற பொதுப் பயன்கள்
[தொகு]தோல் மருத்துவத்தில் நீர்க்கட்டி, பருக்கள் போன்றவற்றை நீக்குவதற்குரிய குளிர்மருத்துவ சிகிச்சையில் நைட்ரசன் பயன்படுகிறது[77]. எக்சுகதிர் உணரிகள், அகச்சிவப்பு உணரிகள், கணிப்பொறிகளின் மையக் கட்டுப்பாட்டு அலகுகள் போன்றவற்றைக் குளிர்விக்கவும் நைட்ரசன் நீர்மம் பயன்படுத்தப்படுகிறது[78].
தாழ்ந்த அழுத்தத்தில் நைட்ரஜன் வழி மின்னிறக்கம் செய்ய,அது மஞ்சள் நிற வெப்பொளியைத் தருகிறது. இது வினைத்திறன் மிக்கதாய் இருப்பதால் பெரும்பாலான உலோகங்கள், அலோகங்களுடன் நேரடியாகக் கூடுகிறது. இம்முறையில் வினைத்திறன் மிக்க நைட்ரசன் உருவாகிறது என்பதனை லார்டு ராலே என்பவர் 1911-ல் கண்டறிந்தார். ஓரளவு மந்தமான வளிமம் என்றாலும் நைட்ரஜன் பல ஆயிரக்கணக்கான வேதிச் சேர்மங்களில் இணைந்திருக்கின்றது. இதன் அமோனிய உப்புக்கள் வேளாண்மைத் துறையில் உரமாகவும், தொழிற்துறையில் உணவுப் பொருளுற்பத்தி மற்றும் அவை கெடாமல் பாதுகாக்கவும், வெடி மருந்து, நஞ்சுப் பொருட்கள், நைட்ரிக் அமிலம் போன்ற வேதிப் பொருட்களின் உற்பத்திக்கு மூலப்பொருளாகவும் விளங்குகிறது. அம்மோனியாவை ஆக்சிஜனேற்ற வினைக்கு உட்படுத்தி நைட்ரிக் அமிலத்தையும் உற்பத்தி செய்ய முடியும்.
பழங்கள் அழுகி விடாமல் பாதுகாக்கவும் நைட்ரசன் வளிமம் பயன்தருகிறது. ஆப்பிள் பழங்களைத் தாழ்ந்த வெப்ப நிலை மற்றும் நைட்ரசன் வெளியில் 30 மாதங்கள் வரை பாதுகாக்க முடியும்.
எண்ணெய்க் கிணறுகளில் நைட்ரசனை அழுத்தி குழாய் வழியாக பூமிக்கு அடியில் செலுத்த, அது அங்குள்ள எண்ணெயை எக்கி வெளிக்கொண்டு வருகிறது. இதையே கூடுதல் எண்ணெய் உற்பத்தி என்பர். இதற்கு வளி மண்டலக் காற்றைப் பயன்படுத்துவதில்லை. ஏனெனில் இதிலுள்ள சில வளிமக் கூறுகள் எண்ணெயோடு வினை புரிந்து வேண்டாத விளை பொருட்களை உற்பத்தி செய்து விடுகின்றன.
நைட்ரசனின் மற்றொரு முக்கியச் சேர்மம் நைட்ரிக் அமிலம். அமோனியம் நைட்ரேட் போன்ற உரங்கள், வெடி மருந்துகள் நைலான் மற்றும் பாலியுரித்தேன் போன்ற நெகிழ்மங்களின் உற்பத்தி முறையில் இது மூலப் பொருளாக உள்ளது. நைட்ரிக் அமிலம் கிளிசராலுடன் வினை புரியும் போது அது நைட்ரோ கிளிசரின் என்ற வலிமைமிக்க வெடி மருந்தை உற்பத்தி செய்கிறது. மிகச் சிறிய அசைவும் உணரப்பட்டு இதை வெடிக்கச் செய்துவிடும்.
டைனமைட்
[தொகு]நைட்ரோ கிளிசரினின் ஒரு துணைப் பொருள் டைனமைட்டாகும். 1867 ல் ஆல்பிரட் நோபல் என்பார் இதைக் கண்டுபிடித்தார். நைட்ரோ கிளிசரினைக் களிமண்ணுடன் கலக்க அது அதிர்வுகளினால் வெடிப்பதில்லை என்ற உண்மையை இவர் கண்டறிந்தார்.
சோடியம் அசைடு(NaN3)என்ற சேர்மம் இன்றைக்கு வளிமப் பொதியுறைகளில் பயன்படுத்தப்படுகிறது. இது ஒரு வெடி பொருள். மோதலின் போது அல்லது எரிக்கும் போது விரைந்து சிதைவுற்று மிகுந்த அளவு நைட்ரசனை வெளிப்படுத்துகிறது. இது பொதியுறையை உப்பச் செய்து மோதலினால் ஏற்படும் விபத்துக்களின் தீவிரத்தை மட்டுப்படுத்துகிறது. கடலில் பயணிப்போருக்கு விபத்துக்களின் போது பாதுகாப்பு உறையாகப் பயன்தருகிறது. 1999 ல் கார்ல் ஒ கிறிசுடி மற்றும் வில்லியம் டபில்யூ வில்சன் என்ற வேதியியலார் நைட்ரசனின் ஒரு புதிய சேர்மத்தைக் கண்டறிந்தனர். இதில் 5 நைட்ரஜன் அணுக்கள் 'V' என்ற வடிவில் ஒன்றோடொன்று பிணைந்துள்ளன. நைட்ரஜன்-13 உமிழும் பாசிட்ரான் உடல் உள்ளுறுப்புகளின் நிழல் படம் காட்டியில் பயன்படுகிறது. இதன் அரை வாழ்வு 9.97 நிமிடங்கள் என்பதால் நோயாளிகளுக்குக் கதிரியக்கத்தால் பெரும் தீங்கு விளைவதில்லை. விரைவிலேயே சிதைந்து அழிந்து விடுகின்றது.
பாதுகாப்பு
[தொகு]வாயு
[தொகு]நைட்ரசன் நச்சுத்தன்மையற்ற வாயுவாக இருந்தாலும், மூடிய அறைக்குள் வெளியிடப்பட்டால் அது ஆக்சிசனை இடப்பெயர்ச்சி செய்யக்கூடும், எனவே மூச்சுத் திணறல் அபாயத்தை அளிக்கிறது. சில எச்சரிக்கை அறிகுறிகளுடன் இத்திணறல் நடக்கும் [79], 1981 இல் நிகழ்த்தப்பட்ட முதலாவது விண்வெளித்திட்டத்தில் இரண்டு தொழில்நுட்ப வல்லுநர்கள நைட்ரசன் வாயுவால் ஏற்பட்ட மூச்சுத்திணறலால் இறந்தனர் என்பது இதற்கான உதாரணமாகும் [80].
நைட்ரசன் வாயுவை உட்சுவாசிக்க நேர்ந்தால் அது மயக்கமருந்தாகவும் செயல்பட வல்லது ஆகும் [81][82]. இரத்தம் மற்றும் உடலில் உள்ள கொழுப்புகளில் நைட்ரசன் வாயு கரைகிறது. விரைவான அழுத்தக் குறைவு (சில நேரங்களில் விண்வெளி வீரர்கள் மிக உயரத்திற்கு செல்லும் போது அழுத்தக் குறைவு) சாத்தியமான அபாயகரமான நிலைக்கு வழிவகுக்கலாம், இரத்த ஓட்டத்தில் நைட்ரசன் குமிழிகள் உருவாகும்போது, நரம்புகள், மூட்டுகள் மற்றும் பிற முக்கிய பகுதிகள் பாதிக்கப்படுகின்றன [83][84]. [85]
திரவநிலை நைட்ரசன்
[தொகு]ஒரு தாழ்வெப்பநிலை திரவமாக, திரவ நைட்ரசன் அபாயகரமான சேர்மமாகக் கருதப்படுகிறது.[86] திரவ நைட்ரசனை உட்கொள்வது கடுமையான உள் சேதத்தை ஏற்படுத்துகிறது. உதாரணமாக, 2012 இல், இங்கிலாந்தில் உள்ள ஒரு இளம் பெண் திரவ நைட்ரசனைக் கொண்ட ஒரு பானத்தைக் குடிக்க நேர்ந்ததால் அவருடைய வயிற்றை அகற்ற வேண்டியிருந்தது[85].
திரவத்திலிருந்து வாயுவாக மாறும் நைட்ரசன் விரிவு விகிதம் 20 பாகை செல்சியசு வெப்பநிலையில் 1:694 ஆகும். இவ்விகித வேகத்தில் மூடிய வெளியில் நைட்ரசன் நீர்மம், வாயுவாக மாறும்போது பேரளவு ஆற்றல் வெளிப்படுகிறது. இப்பேராற்றலால் ஏற்பட்ட இன்னல்கள் தொடர்பான ஆதாரங்கள் உள்ளன[87]
திரவ நைட்ரசன் விரைவாக வாயு நைட்ரசனாக ஆவியாகிவிடுகிறது என்பதால் வாயு நிலை நைட்ரசனுக்கு கூறப்பட்ட முன்னெச்சரிக்கை நடவடிக்கைகள் யாவும் இதற்கும் பொருந்தும் [88][89][90].
திரவ நைட்ரசனைக் கொண்டுள்ள கொள்கலன்கள் காற்றிலிருந்து ஆக்சிசனை ஒடுக்க முடியும். இத்தகைய கொள்கலன்களில் நைட்ரசன் ஆவியாகிவிடுவதால் ஆக்சிசன் அளவு அதிகரிக்கிறது. இதனால் கரிமப் பொருட்களில் தீவிர வன்முறைகள் நிகழ்கின்றன [91].
உசாத்துணை
[தொகு]மேற்கோள்கள்
[தொகு]- ↑ 1.0 1.1 1.2 Greenwood and Earnshaw, pp. 406–7
- ↑ Rutherford, Daniel (1772) "Dissertatio Inauguralis de aere fixo, aut mephitico" (Inaugural dissertation on the air [called] fixed or mephitic), M.D. dissertation, University of Edinburgh, Scotland. English translation: Dobbin, Leonard (1935). "Daniel Rutherford's inaugural dissertation". Journal of Chemical Education 12 (8): 370–375. doi:10.1021/ed012p370.
- ↑ Mary Elvira Weeks (1932). "The discovery of the elements. IV. Three important gases". Journal of Chemical Education 9 (2): 215. doi:10.1021/ed009p215. Bibcode: 1932JChEd...9..215W.
- ↑ Aaron J. Ihde, The Development of Modern Chemistry, New York 1964.
- ↑ Carl Wilhelm Scheele, Chemische Abhandlung von der Luft und dem Feuer [Chemical treatise on air and fire] (Upsala, Sweden: Magnus Swederus, 1777 ; and Leipzig, (Germany): Siegfried Lebrecht Crusius, 1777). In the section titled "Die Luft muß aus elastischen Flüßigkeiten von zweyerley Art, zusammengesetzet seyn." (The air must be composed of elastic fluids of two sorts), pp. 6–14, Scheele presents the results of eight experiments in which air was reacted with various substances. He concluded (p. 13): "So viel sehe ich aus angeführten Versuchen, daß die Luft aus 2 von einander unterschiedenen Flußigkeiten bestehe, von welchen die eine die Eigenschaft das Phlogiston anzuziehen gar nicht äussere, die andere aber zur solchen Attraction eigentlich aufgeleget ist und welche zwischen dem 3:ten und 4:ten Theil von der ganzen Luftmasse aus machet." (So I see [this] much from the experiments [that were] conducted: that the air consists of two fluids [that] differ from one another, of which the one doesn't express at all the property of attracting phlogiston; the other, however, is capable of such attraction and which makes up between 1/3 and 1/4 part of the entire mass of the air.)
- ↑ Priestley, Joseph (1772). "Observations on different kinds of air". Philosophical Transactions of the Royal Society of London 62: 147–256. doi:10.1098/rstl.1772.0021. ; see p. 225.
- ↑ Priestley, Joseph (1772). "Observations on different kinds of air". Philosophical Transactions of the Royal Society of London 62: 147–256. doi:10.1098/rstl.1772.0021. ; see: "VII. Of air infected with the fumes of burning charcoal." pp. 225–228.
- ↑ Elements of Chemistry, trans. Robert Kerr (Edinburgh, 1790; New York: Dover, 1965), p. 52.
- ↑ Chaptal, J. A. and Nicholson, William trans. (1800) Elements of Chemistry, 3rd ed. London, England: C.C. and J. Robinson, vol. 1, pp. xxxv-xxxvi. From pp. xxxv-xxxvi: "In order to correct the Nomenclature on this head [i.e., in this regard], nothing more is necessary than to substitute to [i.e., for] this word a denomination which is derived from the general system made use of; and I have presumed to propose that of Nitrogene Gas. In the first place, it is deduced from the characteristic and exclusive property of this gas, which forms the radical of the nitric acid. By this means we shall preserve to the combinations [i.e., compounds] of this substance the received [i.e., prevailing] denominations, such as those of the Nitric Acid, Nitrates, Nitrites, &c."
- ↑ nitrogen. Etymonline.com. Retrieved 2011-10-26.
- ↑ Strutt, R. J. (1911) "Bakerian Lecture. A chemically active modification of nitrogen, produced by the electric discharge," Proceedings of the Royal Society A, 85 (577): 219–229.
- ↑ Lord Rayleigh's Active Nitrogen பரணிடப்பட்டது 2012-11-01 at the வந்தவழி இயந்திரம். Lateralscience.co.uk. Retrieved 2011-10-26.
- ↑ Erisman, Jan Willem; Sutton, Mark A.; Galloway, James; Klimont, Zbigniew; Winiwarter, Wilfried (2008). "How a century of ammonia synthesis changed the world". Nature Geoscience 1 (10): 636. doi:10.1038/ngeo325. Bibcode: 2008NatGe...1..636E.
- ↑ Improvements in the Manufacture of Nitric Acid and Nitrogen Oxides, January 9, 1902
{{citation}}: Cite has empty unknown parameter:|description=(help); Unknown parameter|country-code=ignored (help); Unknown parameter|inventor-first=ignored (help); Unknown parameter|inventor-last=ignored (help); Unknown parameter|inventorlink=ignored (help); Unknown parameter|issue-date=ignored (help); Unknown parameter|patent-number=ignored (help) - ↑ Improvements in and relating to the Manufacture of Nitric Acid and Oxides of Nitrogen, December 18, 1902
{{citation}}: Cite has empty unknown parameter:|description=(help); Unknown parameter|country-code=ignored (help); Unknown parameter|inventor-first=ignored (help); Unknown parameter|inventor-last=ignored (help); Unknown parameter|inventorlink=ignored (help); Unknown parameter|issue-date=ignored (help); Unknown parameter|patent-number=ignored (help) - ↑ 16.0 16.1 16.2 16.3 16.4 Greenwood and Earnshaw, pp. 411–2
- ↑ Greenwood and Earnshaw, p. 550
- ↑ Kaupp, Martin (1 December 2006). "The role of radial nodes of atomic orbitals for chemical bonding and the periodic table". Journal of Computational Chemistry 28 (1): 320–5. doi:10.1002/jcc.20522. http://depa.fquim.unam.mx/amyd/archivero/LecturasobreNodosRadiales_12854.pdf. பார்த்த நாள்: 14 October 2016.
- ↑ 19.0 19.1 19.2 19.3 19.4 19.5 19.6 19.7 Greenwood and Earnshaw, pp. 412–6
- ↑ Bethe, H. A. (1939). "Energy Production in Stars". Physical Review 55 (5): 434–56. doi:10.1103/PhysRev.55.434. Bibcode: 1939PhRv...55..434B. https://archive.org/details/sim_physical-review_1939-03-01_55_5/page/n9.
- ↑ CIAAW (2003). "Atomic Weight of Nitrogen". ciaaw.org. CIAAW. Retrieved 13 October 2016.
- ↑ Flanagan, Lawrence B.; Ehleringer, James R.; Pataki, Diane E. (15 December 2004). Stable Isotopes and Biosphere - Atmosphere Interactions: Processes and Biological Controls. pp. 74–75. ISBN 978-0-08-052528-0.
- ↑ Greenwood and Earnshaw, p. 408
- ↑ "Evaluated Nuclear Data File (ENDF) Retrieval & Plotting". National Nuclear Data Center.
- ↑ Arthur G Palmer (2007). Protein NMR Spectroscopy. Elsevier Academic Press. ISBN 0-12-164491-X.
- ↑ Katzenberg, M. A. (2008). "Chapter 13: Stable Isotope Analysis: A Tool for Studying Past Diet, Demography, and Life History". Biological Anthropology of the Human Skeleton (2nd ed.). ISBN 978-0-471-79372-4.
- ↑ 27.0 27.1 27.2 Audi, G.; Wapstra, A. H.; Thibault, C.; Blachot, J.; Bersillon, O. (2003). "The NUBASE evaluation of nuclear and decay properties". Nuclear Physics A 729: 3–128. doi:10.1016/j.nuclphysa.2003.11.001. Bibcode: 2003NuPhA.729....3A. http://www.nndc.bnl.gov/amdc/nubase/Nubase2003.pdf.
- ↑ Carlson, Neil (January 22, 2012). Physiology of Behavior. Methods and Strategies of Research. Vol. 11th edition. Pearson. p. 151. ISBN 0-205-23939-0.
- ↑ 29.0 29.1 Neeb, Karl Heinz (1997). The Radiochemistry of Nuclear Power Plants with Light Water Reactors. Berlin-New York: Walter de Gruyter. p. 227. ISBN 3-11-013242-7.
- ↑ 30.0 30.1 Lewars, Errol G. (2008). Modeling Marvels: Computational Anticipation of Novel molecules. இசுபிரிங்கர் பதிப்பகம். pp. 141–163. doi:10.1007/978-1-4020-6973. ISBN 978-1-4020-6972-7.
{{cite book}}: Cite has empty unknown parameter:|coauthors=(help) - ↑ "Polymeric nitrogen synthesized". physorg.com. 5 August 2004. http://www.physorg.com/news693.html. பார்த்த நாள்: 2009-06-22.
- ↑ Gray, Theodore (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2.
- ↑ Schuch, A. F.; Mills, R. L. (1970). "Crystal Structures of the Three Modifications of Nitrogen 14 and Nitrogen 15 at High Pressure". The Journal of Chemical Physics 52 (12): 6000–6008. doi:10.1063/1.1672899. Bibcode: 1970JChPh..52.6000S.
- ↑ Iancu, C. V.; Wright, E. R.; Heymann, J. B.; Jensen, G. J. (2006). "A comparison of liquid nitrogen and liquid helium as cryogens for electron cryotomography". Journal of Structural Biology 153 (3): 231–240. doi:10.1016/j.jsb.2005.12.004. பப்மெட்:16427786.
- ↑ "Flowing nitrogen ice glaciers seen on surface of Pluto after New Horizons flyby". ABC. 25 July 2015. Retrieved 6 October 2015.
- ↑ "Encyclopedia of the Solar System". (3rd). (2014). Amsterdam; Boston: எல்செவியர். 861–882. பன்னாட்டுத் தரப்புத்தக எண் 978-0-12-416034-7.
- ↑ "Neptune: Moons: Triton". தேசிய வானூர்தியியல் மற்றும் விண்வெளி நிர்வாகம் (ஐக்கிய அமெரிக்கா). Archived from the original on அக்டோபர் 5, 2011. Retrieved September 21, 2007.
- ↑ Fryzuk, M. D.; Johnson, S. A. (2000). "The continuing story of dinitrogen activation". Coordination Chemistry Reviews 200–202: 379. doi:10.1016/S0010-8545(00)00264-2.
- ↑ Richard R. Schrock (2005). "Catalytic Reduction of Dinitrogen to Ammonia at a Single Molybdenum Center". Acc. Chem. Res. 38 (12): 955–962. doi:10.1021/ar0501121. பப்மெட்:16359167.
- ↑ 40.0 40.1 40.2 40.3 40.4 Greenwood and Earnshaw, pp. 417–20
- ↑ Greenwood and Earnshaw, pp. 434–8
- ↑ 42.0 42.1 42.2 Greenwood and Earnshaw, pp. 426–33
- ↑ Vieira, R.; C. Pham-Huu; N. Keller; M. J. Ledoux (2002). "New carbon nanofiber/graphite felt composite for use as a catalyst support for hydrazine catalytic decomposition". Chemical Communications (9): 954–955. doi:10.1039/b202032g.
- ↑ 44.0 44.1 44.2 Greenwood and Earnshaw, pp. 438–42
- ↑ Bowden, F. P. (1958). "Initiation of Explosion by Neutrons, α-Particles, and Fission Products". Proceedings of the Royal Society of London A 246 (1245): 216–219. doi:10.1098/rspa.1958.0123.
- ↑ Ford, L. A.; Grundmeier, E. W. (1993). Chemical Magic. Dover. p. 76. ISBN 0-486-67628-5.
- ↑ 47.0 47.1 47.2 47.3 47.4 47.5 Greenwood and Earnshaw, pp. 443–58
- ↑ Rahm, Martin; Dvinskikh, Sergey V.; Furó, István; Brinck, Tore (23 December 2010). "Experimental Detection of Trinitramide, N(NO2)3". Angewandte Chemie International Edition 50 (5): 1145–8. doi:10.1002/anie.201007047.
- ↑ Hou, Y. C.; Janczuk, A.; Wang, P. G. (1999). "Current trends in the development of nitric oxide donors". Current pharmaceutical design 5 (6): 417–41. பப்மெட்:10390607.
- ↑ 50.0 50.1 50.2 50.3 50.4 50.5 50.6 Greenwood and Earnshaw, pp. 459–72
- ↑ 51.0 51.1 March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7
- ↑ "Kjeldahl Method". Encyclopedia of Genetics, Genomics, Proteomics and Informatics. 2008. p. 1063. doi:10.1007/978-1-4020-6754-9_9066. ISBN 978-1-4020-6753-2.
- ↑ 53.0 53.1 Greenwood and Earnshaw, pp. 407–9
- ↑ Nielsen, M. K.; Jørgensen, B. M. (Jun 2004). "Quantitative relationship between trimethylamine oxide aldolase activity and formaldehyde accumulation in white muscle from gadiform fish during frozen storage". Journal of Agricultural and Food Chemistry 52 (12): 3814–3822. doi:10.1021/jf035169l. பப்மெட்:15186102.
- ↑ Knox, G. A. (2007). Biology of the Southern Ocean. CRC Press. p. 392. ISBN 0-8493-3394-6.
- ↑ Vickerstaff Joneja; Janice M. (2004). Digestion, diet, and disease: irritable bowel syndrome and gastrointestinal function. Rutgers University Press. p. 121. ISBN 0-8135-3387-2.
- ↑ Froehlich, Peter (May 2013). "A Sustainable Approach to the Supply of Nitrogen". www.parker.com. Parker Hannifin Corporation. Retrieved 24 November 2016.
- ↑ Reich, Murray; Kapenekas, Harry (1957). "Nitrogen Purfication. Pilot Plant Removal of Oxygen". Industrial & Engineering Chemistry 49 (5): 869–873. doi:10.1021/ie50569a032.
- ↑ 59.0 59.1 59.2 Greenwood and Earnshaw, pp. 409–11
- ↑ 60.0 60.1 Bartlett, J. K. (1967). "Analysis for nitrite by evolution of nitrogen: A general chemistry laboratory experiment". Journal of Chemical Education 44 (8): 475. doi:10.1021/ed044p475. Bibcode: 1967JChEd..44..475B. https://archive.org/details/sim_journal-of-chemical-education_1967-08_44_8/page/475.
- ↑ Eremets, M. I.; Popov, M. Y.; Trojan, I. A.; Denisov, V. N.; Boehler, R.; Hemley, R. J. (2004). "Polymerization of nitrogen in sodium azide". The Journal of Chemical Physics 120 (22): 10618–10623. doi:10.1063/1.1718250. பப்மெட்:15268087. Bibcode: 2004JChPh.12010618E.
- ↑ Ministers, Nordic Council of (2002). Food Additives in Europe 2000. p. 591. பன்னாட்டுத் தரப்புத்தக எண்:978-92-893-0829-8. https://books.google.com/books?id=Fvm-sqd90-oC&pg=PA591.
- ↑ Harding, Charlie, ed. (2002). Elements of the p Block. Cambridge: Royal Society of Chemistry. ISBN 978-0-85404-690-4.
- ↑ Gavriliuk, V. G.; Berns, Hans (1999). High nitrogen steels: structure, properties, manufacture, applications. Springer. ISBN 3-540-66411-4.
- ↑ Meka, S. R.; Chauhan, A.; Steiner, T.; Bischoff, E.; Ghosh, P. K.; Mittemeijer, E. J. (2015). "Generating duplex microstructures by nitriding; nitriding of iron based Fe–Mn alloy". Materials Science and Technology: 1743284715Y.000. doi:10.1179/1743284715Y.0000000098.
- ↑ "Centre Fuel Tank Inerting". B737.org.uk. Retrieved 2013-08-21.
- ↑ "Why don't they use normal air in race car tires?". Howstuffworks. Retrieved 2006-07-22.
- ↑ Kemmochi, Y; Tsutsumi, K.; Arikawa, A.; Nakazawa, H. (2002). "Centrifugal concentrator for the substitution of nitrogen blow-down micro-concentration in dioxin/polychlorinated biphenyl sample preparation". Journal of Chromatography A 943 (2): 295–297. doi:10.1016/S0021-9673(01)01466-2. பப்மெட்:11833649.
- ↑ Baxter, E. Denise; Hughes, Paul S. (2001). Beer: Quality, Safety and Nutritional Aspects. Royal Society of Chemistry. p. 22. ISBN 978-0-85404-588-4.
- ↑ "How does the widget in a beer can work?". Howstuffworks.
- ↑ Denny, Mark (1 November 2009). Froth!: The Science of Beer. p. 131. ISBN 978-0-8018-9569-2.
- ↑ Kennett, Andrew J. (2008). Design of a pneumatically assisted shifting system for Formula SAE® racing applications. Dept. of Mechanical Engineering, Massachusetts Institute of Technology..
- ↑ Sanburn, Josh (2015-04-10). "The Dawn of a New Form of Capital Punishment". டைம். http://time.com/3749879/nitrogen-gas-execution-oklahoma-lethal-injection/. பார்த்த நாள்: 2015-04-11.
- ↑ Sexton, Mike (18 December 2012). "Euthanasia campaigner under scrutiny". ABC. http://www.abc.net.au/7.30/content/2012/s3657550.htm. பார்த்த நாள்: 6 May 2013.
- ↑ Betterton, E. A. (2003). "Environmental Fate of Sodium Azide Derived from Automobile Airbags". Critical Reviews in Environmental Science and Technology 33 (4): 423–458. doi:10.1080/10643380390245002.
- ↑ Kaganer, M. G.; Kozheurov, V.; Levina, Zh. L. (1967). "Vessels for the storage and transport of liquid oxygen and nitrogen". Chemical and Petroleum Engineering 3 (12): 918–922. doi:10.1007/BF01136404.
- ↑ Ahmed I; Agarwal S; Ilchyshyn A; Charles-Holmes S; Berth-Jones J (May 2001). "Liquid nitrogen cryotherapy of common warts: cryo-spray vs. cotton wool bud". Br. J. Dermatol. 144 (5): 1006–9. doi:10.1046/j.1365-2133.2001.04190.x. பப்மெட்:11359389. https://archive.org/details/sim_british-journal-of-dermatology_2001-05_144_5/page/1006.
- ↑ Kent, Allen; Williams, James G. (1994). Encyclopedia of Computer Science and Technology. Vol. 30. CRC Press. p. 318. ISBN 0-8247-2283-3.
- ↑ "Biology Safety – Cryogenic materials. The risks posed by them". University of Bath. Archived from the original on February 6, 2007. Retrieved 2007-01-03.
- ↑ "Space Shuttle Columbia Fast Facts". CNN. September 30, 2013. http://www.cnn.com/2013/09/30/us/space-shuttle-columbia-fast-facts.
- ↑ Fowler, B.; Ackles, K. N.; Porlier, G. (1985). "Effects of inert gas narcosis on behavior—a critical review". Undersea Biomed. Res. 12 (4): 369–402. பப்மெட்:4082343. http://archive.rubicon-foundation.org/3019. பார்த்த நாள்: 2008-09-21.
- ↑ Rogers, W. H.; Moeller, G. (1989). "Effect of brief, repeated hyperbaric exposures on susceptibility to nitrogen narcosis". Undersea Biomed. Res. 16 (3): 227–32. இணையக் கணினி நூலக மையம்:2068005. பப்மெட்:2741255. http://archive.rubicon-foundation.org/2522. பார்த்த நாள்: 2008-09-21.
- ↑ Acott, C. (1999). "A brief history of diving and decompression illness". South Pacific Underwater Medicine Society Journal 29 (2). இணையக் கணினி நூலக மையம்:16986801. http://archive.rubicon-foundation.org/6004. பார்த்த நாள்: 2008-09-21.
- ↑ Kindwall, E. P.; Baz, A.; Lightfoot, E. N.; Lanphier, E. H.; Seireg, A. (1975). "Nitrogen elimination in man during decompression". Undersea Biomed. Res. 2 (4): 285–97. இணையக் கணினி நூலக மையம்:2068005. பப்மெட்:1226586. http://archive.rubicon-foundation.org/2741. பார்த்த நாள்: 2008-09-21.
- ↑ 85.0 85.1 Liquid nitrogen cocktail leaves teen in hospital, BBC News, October 8, 2012.
- ↑ Walker, Jearl. "Boiling and the Leidenfrost Effect". Fundamentals of Physics: 1–4. http://www.wiley.com/college/phy/halliday320005/pdf/leidenfrost_essay.pdf. பார்த்த நாள்: 11 October 2014.
- ↑ Mattox, Brent S. "Investigative Report on Chemistry 301A Cylinder Explosion" (PDF). Texas A&M University. Archived from the original (reprint) on 2008-10-31. Retrieved 2017-05-05.
- ↑ British Compressed Gases Association (2000) BCGA Code of Practice CP30. The Safe Use of Liquid nitrogen Dewars up to 50 litres. பரணிடப்பட்டது 2007-07-18 at the வந்தவழி இயந்திரம் ISSN 0260-4809.
- ↑ Confined Space Entry - Worker and Would-be Rescuer Asphyxiated பரணிடப்பட்டது 2015-09-22 at the வந்தவழி இயந்திரம், Valero Refinery Asphyxiation Incident Case Study.
- ↑ Inquiry after man dies in chemical leak, BBC News, October 25, 1999.
- ↑ Levey, Christopher G. "Liquid Nitrogen Safety". Thayer School of Engineering at Dartmouth.
புற இனைப்புகள்
[தொகு]- Etymology of Nitrogen
- Nitrogen at The Periodic Table of Videos (University of Nottingham)
- Nitrogen podcast from the Royal Society of Chemistry's Chemistry World

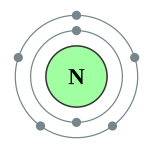

![{\displaystyle {\ce {{NaNO3}+Na2O->[{\ce {Ag~crucible}}][{\ce {300^{\circ }C~for~7days}}]Na3NO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bfabd12fce5ca679d5fa04322b6f6b5d1fd2501a)
