தங்கம்(III) குளோரைடு
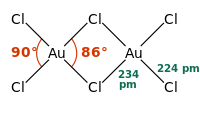
| |
 பந்து-குச்சி ஒப்புரு of AuCl3
| |
 படிகக் கட்டமைப்பு - AuCl3
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
தங்கம்(III) குளோரைடு
| |
| வேறு பெயர்கள்
ஆரிக் குளோரைடு
தங்கம் முக்குளோரைடு | |
| இனங்காட்டிகள் | |
| 13453-07-1 | |
| ChEBI | CHEBI:30076 |
| ChemSpider | 24244 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 26030 |
| வே.ந.வி.ப எண் | MD5420000 |
| |
| UNII | 15443PR153 |
| பண்புகள் | |
| AuCl3 Au2Cl6) ஆக | |
| வாய்ப்பாட்டு எடை | 606.6511 கி/மோல் |
| தோற்றம் | சிவப்பு நிறப் படிகங்கள் (நீரிலி); தங்க நிறம், மஞ்சள் படிகங்கள் (ஒற்றைநீரேற்று)[1] |
| அடர்த்தி | 4.7 கி/செ,மீ3 |
| உருகுநிலை | 160 °C (320 °F; 433 K) (சிதைவடையும்) |
| 68 கி/100 மி.லி (20 °செல்சியசு) | |
| கரைதிறன் | ஈதர் மற்றும் எத்தனால் கரைப்பான்களில் கரையும், நீர்ம அமோனியா கரைப்பானில் சிறிதளவு கரையும், பென்சீனில் கரையாது |
| −112·10−6 cm3/mol | |
| கட்டமைப்பு | |
| படிக அமைப்பு | ஒற்றைச்சரிவச்சு |
| புறவெளித் தொகுதி | P21/C |
| Lattice constant | a = 6.57 Å, b = 11.04 Å, c = 6.44 Å |
படிகக்கூடு மாறிலி
|
|
| சதுரத் தளம் | |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | எரிச்சலூட்டும் |
| GHS pictograms | 
|
| GHS signal word | எச்சரிக்கை |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302+352, P305+351+338 | |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | தங்கம்(III) புளோரைடு தங்கம்(III) புரோமைடு |
| ஏனைய நேர் மின்அயனிகள் | தங்கம்(I) குளோரைடு வெள்ளி குளோரைடு பிளாட்டினம்(II) குளோரைடு பாதரச(II) குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
தங்கம்(III) குளோரைடு (Gold(III) chloride) என்பது Au2Cl6 என்ற மூலக்கூற்று வாய்பாடால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். தங்கமும் குளோரினும் சேர்ந்து உருவாகும் இச்சேர்மம் பாரம்பரியமாக ஆரிக் குளோரைடு என்ற பெயரால் அழைக்கப்படுகிறது. வாய்ப்பாட்டில் உள்ள "III" என்பது தங்கம் +3 ஆக்சிசனேற்ற நிலையைக் கொண்டுள்ளதைக் குறிக்கிறது. தங்கத்தின் பல சேர்மங்களிலும் இக்குறியீடு பொதுவானதாகும். நீரிலி மற்றும் ஒற்றைநீரேற்று தங்கம்(III) குளோரைடு என்று இரண்டு வடிவங்களில் இச்சேர்மம் காணப்படுகிறது. இவ்விரண்டு வடிவ தங்கம்(III) குளோரைடுகளும் திண்மநிலை நீருறிஞ்சிகளாகவும் ஒளி உணரிகளாகவும் உள்ளன. தங்கம்(III) குளோரைடு ஓர் இருபடிச் சேர்மமும் ஆகும். ஓர் ஆக்சிசனேற்ற முகவராகவும் பல்வேறு கரிம வினைகளை ஊக்குவிக்கும் சேர்மமாகவும் சில பயன்பாடுகளைக் கொண்டுள்ளது.
கட்டமைப்பு
[தொகு]தங்கம்(III) குளோரைடு சேர்மம் திண்ம மற்றும் வாயு நிலைகளில் குறைந்த வெப்பநிலையில் குளோரைடு-பாலத்தால் ஆன இருபடிச் சேர்மமாக உள்ளது. தங்கம்(III) புரோமைடு சேர்மத்தை ஒத்ததாக செயல்படுகிறது.[3] கட்டமைப்பை பொறுத்தவரை அயோடின்(III) குளோரைடு கட்டமைப்பை போன்றதாக காணப்படுகிறது.
ஒவ்வொரு தங்க மையமும் தங்கம்(III) குளோரைடில் சதுர தளத்தில் உள்ளன. d8 எலக்ட்ரான் எண்ணிக்கை கொண்ட உலோக அணைவுகளுக்கு இது பொதுவானதாகும். AuCl3 சேர்மத்தில் உள்ள பிணைப்பு ஓரளவு சகப் பிணைப்பு இணைப்பாக கருதப்படுகிறது.[1]
பண்புகள்
[தொகு]தங்கம்(III) குளோரைடு எதிர்காந்தப் பண்பும் ஒளி-உணர்திறனும் கொண்ட சிவப்பு நிற படிகத்திண்மமாகும். இது ஆரஞ்சு நிற ஒற்றைநீரேற்றாகவும் (AuCl3·H2O) உருவாகும். இவ்விரண்டு வடிவ தங்கம்(III) குளோரைடுகளும் திண்மநிலை நீருறிஞ்சிகளாகவும் ஒளி உணரிகளாகவும் உள்ளன. நீரற்ற வடிவம் காற்றில் இருந்து ஈரப்பதத்தை உறிஞ்சி ஒற்றைநீரேற்றாக உருவாகிறது. தயோனைல் குளோரைடு சேர்ப்பதன் மூலம் இச்சேர்மம் நீரற்ற வடிவத்திற்கு மீள்கிறது.
தயாரிப்பு
[தொகு]தங்கம்(III) குளோரைடு முதன்முதலில் 1666 ஆம் ஆண்டு இராபர்ட் பாயில் என்பவரால் உலோகத் தங்கம் மற்றும் குளோரின் வாயு ஆகியவற்றைச் சேர்த்து 180 பாகை செல்சியசு வெப்பநிலையில் வினைபுரியச் செய்து தயாரிக்கப்பட்டது:[1][4][5]
- 2 Au + 3 Cl2 → Au2Cl6
இந்த தயாரிப்பு முறை தங்கம்(III) குளோரைடு தயாரிப்பதற்கான மிகவும் பொதுவான முறையாகும். அயோடின் மோனோகுளோரைடுடன் தங்கப் பொடியைச் சேர்த்து வினைபுரியச் செய்வதன் மூலமும் இதைத் தயாரிக்கலாம்:
- 2 Au + 6 ICl → 2 AuCl3 + 3 I2
டெட்ராபியூட்டைலமோனியம் குளோரைடின் முன்னிலையில் குளோரினேற்ற வினையை நிகழ்த்தினாலும் இது கிடைக்கும். வினையின் விளைபொருள் கொழுப்பில் கரையும் உப்பு டெட்ராபியூட்டைலமோனியம் டெட்ராகுளோரா ஆரேட்டு ஆகும்.[6]
குளோரோ ஆரிக் அமிலம் மூலம் தங்கம் முக்குளோரைடு தயாரிப்பது மற்றொரு தயாரிப்பு முறையாகும். இராசதிராவகத்தில் தங்கத் தூளைக் கரைத்து குளோரோ ஆரிக் அமிலம் தயாரித்துக் கொள்ளப்படுகிறது.
- Au + HNO3 + 4 HCl → H[AuCl4] + 2 H2O + NO
இதன் விளைவாக உருவாகும் குளோரோ ஆரிக் அமிலம் Au2Cl6 ஐ வழங்குவதற்காக சுமார் 100 °செல்சியசு வெப்பநிலையில் மந்த வளிமண்டல சூழலில் சூடேற்றப்படுவதால் தங்கம்(III) குளோரைடு உருவாகிறது::[7]
- 2 H[AuCl4] → Au2Cl6 + 2 HCl
வினைகள்
[தொகு]சிதைவு
[தொகு]நீரற்ற AuCl3 சுமார் 160 °செல்சியசு வெப்பநிலையில் (320 °பாரங்கீட்டு) AuCl (தங்கம்(I) குளோரைடு) ஆக சிதைவடையத் தொடங்குகிறது. இருப்பினும், தங்கம் உலோகம் மற்றும் AuCl3 ஐ வழங்க அதிக வெப்பநிலையில் விகிதாச்சாரமற்ற ஏற்றத்தாழ்வுக்கு உட்பட்டு தங்கம் உலோகம் மற்றும் AuCl3 ஆக பிரிகிறது:[8][7]
- AuCl3 → AuCl + Cl2 (160 °செல்சியசு)
- 3 AuCl → AuCl3 + 2 Au (>210 °செல்சியசு)
AuCl இன் ஏற்றத்தாழ்வான சிதைவு காரணமாக, 210 °செல்சியசு வெப்பநிலைக்கு மேல், பெரும்பாலான தங்கம் தனிமநிலை தங்கம் வடிவில் உள்ளது.[9][10]
தங்கம்(III) குளோரைடு குளோரின் வளிமண்டல சூழலில் மிகவும் நிலையானதாகும். எந்த சிதைவும் இல்லாமல் சுமார் 200 பாகை செல்சியசு வெப்பநிலையில் பதங்கமாகும். AuCl3 254 ° செல்சியசு வெப்பநிலையில் இல் சிதைவடைந்து AuCl சேர்மமாக மாறுகிறது. இது 282 °செல்சியசு வெப்பநிலையில் சிதைந்து தனிமநிலை தங்கமாக மாறுகிறது.[3][11] 400 °செல்சியசு வெப்பநிலைக்கு மேல் தங்க குளோரைடுகள் இருக்க முடியாது. இந்த உண்மை மில்லர் செயல்முறையில் பயன்படுத்தப்படுகிறது,[12]
பிற வினைகள்
[தொகு]AuCl3 ஒரு லூயிசு அமிலமாகும். இது எளிதில் ஒருங்கிணைவுச் சேர்மங்களை க்குகிறது. எடுத்துக்காட்டாக, AuCl3 ஐதரோகுளோரிக் அமிலத்துடன் வினைபுரிந்து குளோரோ ஆரிக் அமிலத்தை (H[AuCl4]) உருவாக்குகிறது:[13]
- HCl + AuCl3 → H+ + [AuCl4]−
இராச திராவகத்தில் தங்கம் கரையும் போது குளோரோ ஆரிக் அமிலம் உருவாகும்.[13]
தண்ணீருடன் தொடர்பு கொள்ளும்போது, AuCl3 அமில நீரேற்றுகளையும் இணைகாரத்தையும் உருவாக்குகிறது. [AuCl3(OH)]−. ஒரு Fe2+ அயனி இதை குறைக்கும். இதனால் கரைசலில் இருந்து தனிமநிலை தங்கம் வீழ்படிவாகும்.[1][14]
KCl போன்ற மற்ற குளோரைடு மூலங்களும் AuCl3 சேர்மத்தை [AuCl4]− சேர்மமாக மாற்றுகின்றன. AuCl3 சேர்மத்தின் நீரிய கரைசல்கள், சோடியம் ஐதராக்சைடு போன்ற நீரிய காரங்களுடன் வினைபுரிந்து Au(OH)3 இன் வீழ்படிவை உருவாக்குகின்றன. இது அதிகப்படியான NaOH காரத்தில் கரைந்து சோடியம் ஆரேட்டை (NaAuO2) உருவாக்கும். மெதுவாக சூடுபடுத்தப்பட்டால், Au(OH)3 சேர்மம் தங்கம்(III) ஆக்சைடு, Au2O3 மற்றும் தங்கம் உலோகமாக சிதைவடைகிறது.[13][15][16][17]
தங்கம்(III) குளோரைடு பல தங்கம் சேர்மங்களின் தயாரிப்பிற்கான வேதியியல் தொகுப்பு வினைகளின் தொடக்கப் புள்ளியாகும். எடுத்துக்காட்டாக, பொட்டாசியம் சயனைடுடனான வினை நீரில் கரையக்கூடிய அணைவுச் சேர்மத்தை (K[Au(CN)4]) உருவாக்குகிறது:[18]
- AuCl3 + 4 KCN → K[Au(CN)4] + 3 KCl
தங்கம்(III) குளோரைடுடன் புரோமின் முப்புளோரைடு சேர்மத்தைச் சேர்த்து வினைபுரியச் செய்தால் தங்கம்(III) புளோரைடு சேர்மமும் உருவாகும்.[13]
தங்கம்(III) குளோரைடு பென்சீனுடன் மிதமான சூழ்நிலையில் (அறை வெப்பநிலையில் சில நிமிட வினை நேரம்) வினைபுரிந்து இருபடி பீனைல்தங்கம்(III) இருகுளோரைடை உருவாக்குகிறது; மற்ற பல்வேறு அரீன்களும் இதேபோன்ற வினைக்கு உட்படுகின்றன.[19]
- 2 PhH + Au2Cl6 → [PhAuCl2]2 + 2 HCl
தங்கம்(III) குளோரைடு கார்பன் மோனாக்சைடுடன் பல்வேறு வழிகளில் வினைபுரிகிறது. எடுத்துக்காட்டாக, SOCl2 சேர்மத்தின் முன்னிலையில் நீரற்ற AuCl3 மற்றும் கார்பன் மோனாக்சைடு ஆகியவற்றின் வினையானது தங்கம்(I,III) குளோரைடை உருவாக்குகிறது. உடன் Au(CO)Cl இடைநிலையாக உருவாகிறது.:[20][21]
- 2 AuCl3 + 2 CO → Au4Cl8 + 2 COCl2
ஒருவேளை கார்பன் மோனாக்சைடு அதிகமாக இருந்தால், அதற்கு பதிலாக Au(CO)Cl உற்பத்தி செய்யப்படுகிறது.[22][23]
இருப்பினும், டெட்ராகுளோரோயெத்திலீனின் கீழ் 120 °செல்சியசு வெப்பநிலையில் தங்கம்(III) குளோரைடு முதலில் தங்கம்(I) குளோரைடாகக் குறைக்கப்படுகிறது, இது மேலும் வினைபுரிந்து Au(CO)Cl சேர்மத்தை உருவாக்குகிறது. AuCl3 பாசுச்சீன் உற்பத்தியை ஊக்குவிப்பதாகவும் அறியப்படுகிறது.[23][24]
பயன்கள்
[தொகு]தங்கம்(III) குளோரைடுக்கு வணிகரீதியான பயன்பாடுகள் இல்லை என்றாலும், அது ஆய்வகத்தில் பல பயன்பாடுகளைக் கொண்டுள்ளது
கரிமத் தொகுப்பு வினைகள்
[தொகு]2003 ஆம் ஆண்டு முதல், எந்த மாற்றங்களும் வணிகமயமாக்கப்படவில்லை என்றாலும் AuCl3 பல்வேறு வினைகளுக்கு ஓர் இலேசான அமில வினையூக்கியாக கரிமவியல் வேதியியலாளர்களின் ஆர்வத்தை ஈர்த்து வருகிறது.[25] தங்கம்(III) உப்புகள், குறிப்பாக Na[AuCl4], ஆல்கைன்கள் சம்பந்தப்பட்ட வினைகளுக்கு வினையூக்கியாக பாதரசம்(II) உப்புகளுக்கு மாற்றாகப் பயன்படுகிறது. விளிம்பு நிலை ஆல்கைன்களை நீரேற்றம் செய்து அசிட்டைல் சேர்மங்களை உருவாக்குதல் ஒரு விளக்க வினை ஆகும்.[26]
தங்கமானது சில அரோமாட்டிக் வளையங்களை ஆல்கைலேற்றுதல் மற்றும் பியூரான்களை பீனால்களாக மாற்றுதல் ஆகிய வினைகளை ஊக்குவிக்கிறது. சில ஆல்கைன்கள் தங்கம்(III) வினையூக்கிகள் முன்னிலையில் அமினேற்றம் செய்யப்படுகின்றன. எடுத்துக்காட்டாக, அசிட்டோ நைட்ரைல் மற்றும் தங்கம்(III) குளோரைடு ஆகியவற்றின் கலவையானது 2-மெத்தில்பியூரானின் ஆல்கைலேற்றத்தை மெத்தில் வினைல் கீட்டோனால் 5 ஆவது நிலையில் தூண்டுகிறது:
இந்த கரிமத் தங்கத் தொகுப்பு வினையின் செயல்திறன் குறிப்பிடத்தக்கது, ஏனெனில் பியூரான் மற்றும் கீட்டோன் இரண்டும் அமில நிலைகளின் கீழ் பலபடியாக்கல் போன்ற பக்கவிளைவுகளுக்கு உணர்திறன் கொண்டவையாகும். ஆல்கைன்கள் இருக்கும் சில சந்தர்ப்பங்களில், பீனால்கள் சில நேரங்களில் உருவாகின்றன (Ts என்பது தொசில் எனப்படும் தொலுயீன் சல்போனைல் குழுவின் சுருக்கம் ஆகும்):[27]
இந்த வினை ஒரு புதிய அரோமாட்டிக் வளையத்தை வழங்கும் மறுசீரமைப்பை உள்ளடக்கியுள்ளது.[28]
AuCl3 சேர்மம் வினையூக்கியாகச் செயல்படும் வினையின் மற்றொரு உதாரணம் ஐதரோ அரைலேற்ற வினையாகும். இது அடிப்படையில் உலோக-அல்கைன் அணைவுச் சேர்மங்களைப் பயன்படுத்தி மேற்கொள்ளப்படும் பிரீடெல்-கிராப்ட்சு வினையாகும். உதாரணம், பீணைல் அசிட்டிலீனுடன் மெசிட்டிலீன் ஈடுபடும் வினை:[29]
தங்கம்(III) குளோரைடை முதல்நிலை அமீன்களை கீட்டோன்களாக நேரடியாக ஆக்சிசனேற்றம் செய்ய பயன்படுத்தலாம். வளையயெக்சைலமீனை வளையயெக்சனோனாக ஆக்சிசனேற்றம் செய்யும் வினை இதற்கு எடுத்துக்காட்டாகும். [8]
இந்த எதிர்வினை pH உணர்திறன் கொண்டது. வினையைத் தொடர ஒரு இலேசான அமில pH தேவைப்படுகிறது. இருப்பினும், இதற்கு கூடுதல் படிகள் எதுவும் தேவையில்லை.[8]
கரிமத்தங்கம்(III) சேர்மங்களின் உற்பத்தியில், AuCl3 தங்கத்தின் மூலமாகப் பயன்படுத்தப்படுகிறது. மோனோ அரைல் தங்கம்(III) அணைவுச் சேர்மங்கள் தயாரிக்கும் வினையை இதற்கு எடுத்துக்காட்டாகக் கூறலாம். தங்கம்(III) குளோரைடு மூலம் அரீன்களின் நேரடி அணுக்கருகவரி தங்கமேற்றம் வினை மூலம் இது உற்பத்தி செய்யப்படுகிறது.[30]
தங்கம் நானோதுகள்கள்
[தொகு]தங்கம்(III) குளோரைடு தங்க நானோ துகள்களின் தயாரிப்பில் பயன்படுத்தப்படுகிறது. இவை அவற்றின் தனித்துவமான அளவு சார்ந்த பண்புகள் மற்றும் மின்னணுவியல், ஒளியியல் மற்றும் உயிர் மருத்துவம் போன்ற துறைகளில் பயன்பாடுகளுக்காக விரிவாக ஆய்வு செய்யப்படுகின்றன. தங்கம்(III) குளோரைடை சோடியம் டெட்ராபுளோரோபோரேட்டு போன்ற குறைக்கும் முகவர் மூலம் குறைப்பதன் மூலம் தங்க நானோ துகள்களைத் தயாரித்து நிலைப்பத்தலாம்.[31]
புகைப்படவியல்
[தொகு]தங்கம்(III) குளோரைடு புகைப்படத் துறையில் வரலாற்று ரீதியாக புகைப்படத் திரைப்படங்கள் மற்றும் காகிதங்களின் தயாரிப்பில் ஒரு உணர்திறனாகப் பயன்படுத்தப்படுகிறது. இருப்பினும், எண்ணிம புகைப்படக்கலையின் வருகையால் புகைப்படத் துறையில் இதன் பயன்பாடு குறைந்துவிட்டது.[32]
இயற்கைத் தோற்றம்
[தொகு]தங்கம்(III) குளோரைடு சேர்மம் இயற்கையாக தோன்றுவதில்லை. இருப்பினும், AuO(OH,Cl)·nH2O என்ற வாய்பாட்டுடன் ஒத்த ஒரு சேர்மம் இயற்கையான தங்கத்தின் ஆக்சிசனேற்றத்தின் விளைவாக அறியப்படுகிறது.[33][34]
மேற்கோள்கள்
[தொகு]- ↑ 1.0 1.1 1.2 1.3 Egon Wiberg; Nils Wiberg; A. F. Holleman (2001). Inorganic Chemistry (101 ed.). Academic Press. pp. 1286–1287. பன்னாட்டுத் தரப்புத்தக எண் 978-0-12-352651-9.
- ↑ "Gold Chloride". American Elements. பார்க்கப்பட்ட நாள் July 22, 2019.
- ↑ 3.0 3.1 E. S. Clark; D. H. Templeton; C. H. MacGillavry (1958). "The crystal structure of gold(III) chloride". Acta Crystallogr. 11 (4): 284–288. doi:10.1107/S0365110X58000694. http://scripts.iucr.org/cgi-bin/paper?S0365110X58000694. பார்த்த நாள்: 2010-05-21.
- ↑ Robert Boyle (1666). The origine of formes and qualities (in ஆங்கிலம்). p. 370.
- ↑ Thomas Kirke Rose (1895). "The dissociation of chloride of gold" (in en). Journal of the Chemical Society, Transactions 67: 881–904. doi:10.1039/CT8956700881. https://zenodo.org/record/1784163.
- ↑ Buckley, Robbie W.; Healy, Peter C.; Loughlin, Wendy A. (1997). "Reduction of [NBu4][AuCl4] to [NBu4][AuCl2] with Sodium Acetylacetonate". Australian Journal of Chemistry 50 (7): 775. doi:10.1071/C97029. https://archive.org/details/sim_australian-journal-of-chemistry_1997_50_7/page/775.
- ↑ 7.0 7.1 Ya-jie Zheng; Wei Guo; Meng Bai; Xing-wen Yang (2006). "Preparation of chloroauric acid and its thermal decomposition" (in chinese). The Chinese Journal of Nonferrous Metals 16 (11): 1976–1982. http://ysxb.csu.edu.cn/previewFile?id=36231978&type=pdf&lang=en.
- ↑ 8.0 8.1 8.2 Michael J. Coghlan; Rene-Viet Nguyen; Chao-Jun Li; Daniel Pflästerer; A. Stephen K. Hashmi (2015). "Gold(III) Chloride". Encyclopedia of Reagents for Organic Synthesis: 1–24. doi:10.1002/047084289X.rn00325.pub3. பன்னாட்டுத் தரப்புத்தக எண்:9780470842898.
- ↑ Yiqin Chen; Xuezeng Tian; Wei Zeng; Xupeng Zhu; Hailong Hu; Huigao Duan (2015). "Vapor-phase preparation of gold nanocrystals by chloroauric acid pyrolysis" (in en). Journal of Colloid and Interface Science (Elsevier) 439: 21–27. doi:10.1016/j.jcis.2014.10.017. பப்மெட்:25463171. Bibcode: 2015JCIS..439...21C.
- ↑ Robert G. Palgrave; Ivan P. Parkin (2007). "Aerosol Assisted Chemical Vapor Deposition of Gold and Nanocomposite Thin Films from Hydrogen Tetrachloroaurate(III)" (in en). Chemistry of Materials (ACS Publications) 19 (19): 4639–4647. doi:10.1021/cm0629006.
- ↑ E.M.W. Janssen; J.C.W. Folmer; G.A. Wiegers (1974). "The preparation and crystal structure of gold monochloride, AuCl" (in en). Journal of the Less Common Metals 38 (1): 71–76. doi:10.1016/0022-5088(74)90204-5.
- ↑ Hermann Renner; Günther Schlamp (2000). "Gold, Gold Alloys, and Gold Compounds". Ullmann's Encyclopedia of Industrial Chemistry. pp. 106–107. எண்ணிம ஆவணச் சுட்டி:10.1002/14356007.a12_499. பன்னாட்டுத் தரப்புத்தக எண் 978-3-527-30673-2.
- ↑ 13.0 13.1 13.2 13.3 N. N. Greenwood; A. Earnshaw (1997). Chemistry of the Elements (in ஆங்கிலம்) (2 ed.). Oxford, UK: Butterworth-Heinemann. pp. 1184–1185. பன்னாட்டுத் தரப்புத்தக எண் 9780750633659.
- ↑ Cotton, F.A.; Wilkinson, G.; Murillo, C.A.; Bochmann, M. Advanced Inorganic Chemistry; John Wiley & Sons: New York, 1999; pp. 1101-1102
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Ed., 2006, p. 780, பன்னாட்டுத் தரப்புத்தக எண் 978-0-911910-00-1.
- ↑ H. Nechamkin, The Chemistry of the Elements, McGraw-Hill, New York, 1968, p. 222
- ↑ A. F. Wells, Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984, p. 909
- ↑ Henry K. Lutz (1961). "Synthesis and Analyses of KAu(CN)4" (in en). Honors Theses. (Union Digital Works). https://digitalworks.union.edu/theses/1986.
- ↑ Li, Zigang; Brouwer, Chad; He, Chuan (2008-08-01). "Gold-Catalyzed Organic Transformations". Chemical Reviews 108 (8): 3239–3265. doi:10.1021/cr068434l. பன்னாட்டுத் தர தொடர் எண்:0009-2665. பப்மெட்:18613729.
- ↑ Daniela Belli Dell'Amico; Fausto Calderazzo; Fabio Marchetti; Stefano Merlino; Giovanni Perego (1977). "X-Ray crystal and molecular structure of Au4Cl8, the product of the reduction of Au2Cl6 by Au(CO)Cl" (in en). Journal of the Chemical Society, Chemical Communications: 31–32. doi:10.1039/C39770000031.
- ↑ Daniela Belli Dell'Amico; Fausto Calderazzo; Fabio Marchetti; Stefano Merlino (1982). "Synthesis and molecular structure of [Au4Cl8], and the isolation of [Pt(CO)Cl5]– in thionyl chloride" (in en). Journal of the Chemical Society, Dalton Transactions (11): 2257–2260. doi:10.1039/DT9820002257.
- ↑ Dell'Amico, D. Belli; Calderazzo, F.; Murray, H. H.; Fackler, J. P. (1986). "Carbonylchlorogold(I)". Inorganic Syntheses. Vol. 24. pp. 236–238. எண்ணிம ஆவணச் சுட்டி:10.1002/9780470132555.ch66. பன்னாட்டுத் தரப்புத்தக எண் 9780470132555.
- ↑ 23.0 23.1 T.A. Ryan; E.A. Seddon; K.R. Seddon; C. Ryan (1996). Phosgene And Related Carbonyl Halides (in ஆங்கிலம்). Elsevier Science. pp. 242–243. பன்னாட்டுத் தரப்புத்தக எண் 9780080538808.
- ↑ M. S. Kharasch; H. S. Isbell (1930). "The Chemistry of Organic Gold Compounds. I. Aurous Chloride Carbonyl and a Method of Linking Carbon to Carbon" (in en). Journal of the American Chemical Society 52 (7): 2919–2927. doi:10.1021/ja01370a052.
- ↑ G. Dyker, An Eldorado for Homogeneous Catalysis?, in Organic Synthesis Highlights V, H.-G. Schmaltz, T. Wirth (eds.), pp 48–55, Wiley-VCH, Weinheim, 2003
- ↑ Y. Fukuda; K. Utimoto (1991). "Effective transformation of unactivated alkynes into ketones or acetals with a gold(III) catalyst". J. Org. Chem. 56 (11): 3729. doi:10.1021/jo00011a058.
- ↑ A. S. K. Hashmi; T. M. Frost; J. W. Bats (2000). "Highly Selective Gold-Catalyzed Arene Synthesis". J. Am. Chem. Soc. 122 (46): 11553. doi:10.1021/ja005570d.
- ↑ A. Stephen; K. Hashmi; M. Rudolph; J. P. Weyrauch; M. Wölfle; W. Frey; J. W. Bats (2005). "Gold Catalysis: Proof of Arene Oxides as Intermediates in the Phenol Synthesis". Angewandte Chemie International Edition 44 (18): 2798–801. doi:10.1002/anie.200462672. பப்மெட்:15806608.
- ↑ Reetz, M. T.; Sommer, K. (2003). "Gold-Catalyzed Hydroarylation of Alkynes". European Journal of Organic Chemistry 2003 (18): 3485–3496. doi:10.1002/ejoc.200300260.
- ↑ Kharasch, M. S.; Isbell, Horace S. (1931-08-01). "The Chemistry of Organic Gold Compounds. III. Direct Introduction of Gold into the Aromatic Nucleus (Preliminary Communication)". Journal of the American Chemical Society 53 (8): 3053–3059. doi:10.1021/ja01359a030. பன்னாட்டுத் தர தொடர் எண்:0002-7863.
- ↑ M. Lin; C. M. Sorensen; K. J. Klabunde (1999). "Ligand-Induced Gold Nanocrystal Superlattice Formation in Colloidal Solution" (in en). Chemistry of Materials 11 (2): 198–202. doi:10.1021/cm980665o.
- ↑ Philip Ellis (1975). "Gold in photography" (in en). Gold Bulletin 8: 7–12. doi:10.1007/BF03215055.
- ↑ "UM1995-16-O:AuClH". mindat.org. பார்க்கப்பட்ட நாள் 27 April 2023.
- ↑ John L. Jambor; Nikolai N. Pertsev; Andrew C. Roberts (1996). "New Mineral Names" (in en). American Mineralogist 81: 768. http://www.minsocam.org/msa/ammin/toc/Articles_Free/1996/Jambor_p766-770_96.pdf.






