வேதியியல்

இரசாயனவியல் (Chemistry) எனப்படுவது அணுக்களால் அதாவது தனிமங்கள் மற்றும் மூலக்கூறுகள் இணைந்து உருவாகும் சேர்மங்களைப் பற்றி ஆராய்கின்ற ஓர் அறிவியல் துறையாகும். பொதுவாக அணுக்களின் இணை இங்கு முக்கியத்துவம் பெறுகிறது. இவற்றின் இயைபு, கட்டமைப்பு மற்றும் அதனால் உருவாகும் பண்புகள் பற்றிய அனைத்து செய்திகளும் இத்துறையில் ஆராயப்படும். அணுக்களும் மூலக்கூறுகளும் இரசாயனப் பிணைப்புகளிலாகின்றன என்பது இங்கு விவரிக்கப்படுகிறது[1][2] .பல வகையான பிணைப்புகள் உள்ளன. அவற்றில் ஒன்று சகப்பிணைப்பு ஆகும். இவ்வகைப் பிணைப்பில் ஒன்று சகப்பிணைப்பு ஆகும் . ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்கள் இவ்வகைப் பிணைப்பில் பகிரப்படுகின்றன. ஒரு சேர்மம் மற்றொரு சேர்மத்திற்கு எலக்ட்ரான்களை கொடையளிப்பது அயனிப் பிணைப்பாகும். இவை தவிர ஐதரசன் பிணைப்பு, வாண்டர்வால்ஸ் பிணைப்பு என்ற பிலங்கள் ஆகும். மேலும் பின்வருவனவற்றை வேறு பிரிவுகளாகக் கருதலாம்.
- கரிமயியல் (ப) – Organic Chemistry
- கனிம வேதியியல்அசேதன இரசாயனம்) – Inorganic Cemistry
- இயபௌதீக இரசாயனம்) – Physical Chemistry
அணுக்கள் பற்றியும், அவ்வணுக்களுடன் இடைவினைகள் பற்றியும், சிறப்பாக வேதியியல் பிணைப்புக்களின் இயல்புகள் குறித்தும் கவனம் செலுத்துகிறது.
நிலவியல், பிற இயற்கை அறிவியல்கள் அறிவியல் துகளை இயற்ப இணைக்கும் துறையாக வேதியியல் இருப்பதால், சில வேளைகளில் வேதியியலை "அறிவியலின் மையம்" என்பதுண்டு. வேதியியல் இயற்பிய அறிவியலின் ஒரு பகுதியாக இருப்பினும், இது இயற்பியலில் இருந்தும் வேறானது.
| பின்வரும் தலைப்பின் பிரிவுகள் |
| அறிவியல் |
|---|
 |
கோட்பாடு
[தொகு]
மரபுவழி வேதியியலானது, அடிப்படைத் துகள்கள், அணுக்கள், மூலக்கூறுகள், சாரப்பொருட்கள், உலோகங்கள், பளிங்குகள், பிற பொருட் சேர்க்கைகள் என்பன பற்றி ஆய்வு செய்கிறது. இவ்வாய்வு அப் பொருட்களின் திண்ம, நீர்ம அல்லது வளிம நிலையில் தனித்தனியாகவோ அல்லது கூட்டாகவோ இடம்பெறலாம். வேதியியலில் ஆராயப்படும் இடைவினைகள், தாக்கங்கள், மாற்றங்கள் என்பன வேதிப்பொருட்களிடையே இடம்பெறும் இடைவினைகளின் விளைவாக அல்லது பொருளுக்கும் ஆற்றலுக்கும் இடையேயான இடைவினைகளின் விளைவாக ஏற்படுபவை. வேதிப் பொருட்களின் இவ்வாறான நடத்தைகள் பற்றிய ஆய்வுகள், வேதியியல் ஆய்வு கூடங்களில் நடைபெறுகின்றன.
"வேதியியல் தாக்கம்" அல்லது "வேதிவினை" என்பது சில சாரப்பொருட்கள் ஒன்று அல்லது பல சாரப்பொருட்களாக மாற்றம் அடைவதைக் குறிக்கிறது. இதை ஒரு வேதிச் சமன்பாட்டினால் குறியீடாக வெளிப்படுத்த முடியும். இச் சமன்பாடுகளின் வலது பக்கத்திலும், இடது பக்கத்திலும் உள்ள அணுக்களின் எண்ணிக்கை மிகப் பெரும்பாலும் ஒரே அளவாக இருக்கும். ஒரு சாரப்பொருள் உட்படும் வேதிவினைகளின் இயல்புகளும், அதனோடு ஆற்றல் மாற்றங்களும், வேதியியல் விதிகள் எனப்படும் சில அடிப்படை விதிகளுக்கு அடங்குவனவாக உள்ளன.
ஆற்றல், மாற்றீட்டு வெப்பம் ஆகியவற்றைக் கருத்துக்கு எடுத்தல் ஏறத்தாழ எல்லா வேதியியல் ஆய்வுகளிலுமே முக்கியமாக உள்ளது. வேதிச் சாரப்பொருட்களை, அவற்றின் கட்டமைப்பு, நிலை, வேதியியல் சேர்க்கை என்பவற்றின் அடிப்படையில் வகைப்படுத்துகின்றனர். இவற்றை வேதியியல் பகுப்பாய்வுகளுக்கான கருவிகளின் துணையுடன் பகுத்தாய்வு செய்ய முடியும். வேதியியல் ஆய்வுகளில் ஈடுபடும் அறிவியலாளர்கள் வேதியியலாளர் எனப் பெயர் பெறுவர். வேதியியலாளர்கள் ஒன்று அல்லது அதற்கு மேற்பட்ட வேதியியலின் துணைப் பிரிவுகளில் சிறப்புத் தகைமைகளைக் கொண்டிருப்பது உண்டு.
வரலாறு
[தொகு]பண்டைய எகிப்தியர்கள் கிமு 4000 ஆண்டுகளுக்கு முன்பே செயற்கை வேதியியலின் முன்னோடிகளாகத் திகழ்ந்தனர். கிமு 1000 ஆண்டளவிலேயே பண்டைய நாகரிக மக்கள் வேதியியலின் பல்வேறு துணைப் பிரிவுகளுக்கு அடிப்படையாக அமையும் தொழில்நுட்பங்களைப் பயன்படுத்தி உள்ளனர். இவற்றுள் கனிம மூலங்களில் இருந்து உலோகங்களைப் பிரித்து எடுத்தல், மட்பாண்டங்களை வனைந்து மெருகிடல், நொதிக்கவைத்துக் மதுவகைகள் தயாரித்தல், ஆடைகளுக்கும், நிறந்தீட்டலுக்கும் வேண்டிய வண்ணங்களைத் தயாரித்தல், மருந்துகளையும் வாசனைப் பொருட்களையும் செய்வதற்கு தாவரங்களில் இருந்து வேதிப் பொருட்களைப் பிரித்தெடுத்தல், பாற்கட்டிகளைச் செய்தல், ஆடைகளுக்கு நிறமூட்டல், தோலைப் பதப்படுத்துதல், கொழுப்பிலிருந்து சவர்க்காரம் உற்பத்திசெய்தல், கண்ணாடி உற்பத்தி, வெண்கலம் போன்ற கலப்புலோகங்களை உருவாக்குதல் போன்றவை அடங்கும்.

வேதியியல், தாதுப் பொருட்களில் இருந்து உலோகங்களைப் பிரித்து எடுப்பதற்கு வழி சமைத்த எரிதல் என்னும் தோற்றப்பாட்டில் இருந்து தோற்றம் பெற்றதாகக் கொள்ளலாம். அடிப்படையான கோட்பாடுகளைப் புரிந்து கொள்ளாவிட்டாலும் பொன்னின் மீதிருந்த பேராசை அதனை தூய்மையாக்கும் வழிமுறைகளைக் கண்டுபிடிக்க உதவியது. இது தூய்மையாக்குதல் என்றில்லாமல் ஒரு மாற்றம் என்றே அக்காலத்தில் எண்ணியிருந்தனர். அக்காலத்து அறிஞர்கள் பலர் மலிவான உலோகங்களைப் பொன்னாக மாற்றுவதற்கான வழிமுறைகள் உள்ளன என நம்பினர். இது இரசவாதம் தோன்றுவதற்கு அடிப்படை ஆகியதுடன், மூல உலோகங்களைத் தொட்டதும் பொன்னாக மாற்றக்கூடிய "இரசவாதக்கல்"லைத் தேடும் முயற்சிகளுக்கும் வித்திட்டது.
கிமு 50 ஆம் ஆண்டில் உரோமரான லூக்கிரட்டியசு என்பவர் எழுதிய பொருட்களின் இயல்பு (De Rerum Natura) என்னும் நூலில் கண்டபடி,கிரேக்கர்களின் அணுவியக் கோட்பாடு கிமு 440க்கு முற்பட்ட பழமை வாய்ந்தது. தூய்மையாக்க வழிமுறைகளின் தொடக்ககால வளர்ச்சிகளில் பெரும்பாலானவை குறித்து மூத்த பிளினி என்பவர் தனது இயற்கைசார் வரலாறு (Naturalis Historia) என்னும் தனது நூலில் விளக்கியுள்ளார். வேதியியலின் வளர்ச்சிப் போக்கைப் பருமட்டாகப் பின்வருமாறு வரிசைப்படுத்தலாம்:
- எகிப்திய இரசவாதம் (கிமு 300 – கிமு 400), "ஆக்டோவாட்" (எண்மடங்கு) போன்ற தொடக்ககாலத் தனிமக் கோட்பாடுகளை உருவாக்கியது.
- கிரேக்க இரசவாதம் (கிமு 332 – கிபி 642), மசிடோனியப் பேரரசர் அலெக்சாந்தர் எகிப்தைக் கைப்பற்றியபோது அதன் தலைநகர் அலெக்சாந்திரியாவில் உலகின் மிகப்பெரிய நூலகம் இருப்பதையும் அங்கே அறிஞர்கள் ஒன்றுகூடி ஆய்வு செய்வதையும் அறிந்துகொண்டார்.
- இசுலாமிய இரசவாதம் (கிபி 642 – 1200), இசுலாமியர் எகிப்தைக் கைப்பற்றினர். சாபிர் இபின் அய்யான், அல்-ராசி போன்றோர் இரசவாதத்தை வளர்த்தனர், சாபிர் அரிசுட்டாட்டிலின் கோட்பாடுகளைத் திருத்தியமைத்தார். வழிமுறைகளிலும் கருவிகளிலும் மாற்றங்கள் ஏற்பட்டன.
- ஐரோப்பிய இரசவாதம் (1300 – இன்றுவரை), சியுடோ-கெபர் என்பார் அராபிய வேதியியலை அடிப்படையாக வைத்து மேலும் அதனை வளர்த்தெடுத்தார். 12 ஆம் நூற்றாண்டில் இருந்து பெரிய முன்னேற்றங்கள் அராபிய மண்ணிலிருந்து ஐரோப்பாவுக்கு மாறின.
- வேதியியல் (1661), போயில் வேதியியலில் முக்கியமான நூலொன்றை (The Sceptical Chymist) எழுதினார்.
- வேதியியல் (1788), இலவோசியே என்பார் தனது "வேதியியலின் கூறுகள்" (Elements of Chemistry) என்னும் நூலை எழுதி வெளியிட்டார்.
- வேதியியல் (1803), டால்ட்டனின் "அணுக் கோட்பாடு" என்னும் நூல் வெளியானது.
- வேதியியல் (1869), டிமிட்றி மென்ட்லீவ் தற்கான வேதியியலின் சட்டகமாக அமைந்திருக்கும் ஆவர்த்தன அட்டவணையை முன்வைத்தார்.
தற்கால வேதியியலின் முன்னோடிகளும், தற்கால அறிவியல் வழிமுறைகளைக் கண்டுபிடித்தவர்களும் நடுக் காலத்தைச் சேர்ந்த அராபிய, பாரசீக அறிஞர்கள் ஆவர். இவர்கள் துல்லியமான கவனிப்புக்களையும், கட்டுப்பாடுள்ள பரிசோதனை முறைகளையும் அறிமுகப் படுத்தியதுடன், புதிய பல வேதிப் பொருட்களையும் கண்டறிந்தனர்.
"அறிவியல் என்ற வகையில் வேதியியலை முழுமையாக உருவாக்கியவர்கள் முசுலிம்கள் எனலாம். இத்துறையில் கிரேக்கர்கள் தொழில்துறைப் பட்டறிவுகளுடனும், தெளிவற்ற எடுகோள்களுடனும் நிறுத்திக்கொள்ள, முசுலிம்கள் துல்லியமான கவனிப்புகளையும், கட்டுப்பாடுள்ள சோதனை முறைகளையும், கவனமான குறிப்பெடுத்தலையும் அறிமுகப்படுத்தினர். "அலெம்பிக்" என அழைக்கப்பட்ட வடிகலன்களைக் கண்டுபிடித்துப் பெயரிட்டனர், எண்ணற்ற சாரப்பொருட்களை வேதியியல் முறைப்படி பகுப்பாய்வு செய்தனர், கல் சார்ந்த பொருட்களை உருவாக்கினர், காரத்தையும், அமிலத்தையும் வேறுபடுத்தினர், அவற்றின் நாட்டப் பண்புகள் குறித்து ஆய்வு செய்தனர், நூற்றுக் கணக்கான மருந்துகள் குறித்து ஆய்வு செய்து உற்பத்தி செய்தனர். முசுலிம்களுக்கு எகிப்தின் வழியாகக் கிடைத்த இரசவாதம், ஆயிரக் கணக்கான துணை விளைவுக் கண்டுபிடிப்புக்களூடாகவும், மத்திய காலத்தின் மிகச் சிறந்த அறிவியல் செயற்பாடாக விளங்கிய அதன் வழிமுறைகளூடாகவும் வேதியியலுக்குப் பங்களிப்புச் செய்தது."
மிகவும் செல்வாக்குப் பெற்றிருந்த முசுலிம் வேதியியலாளர்களுள் சாபிர் இபின் ஐய்யான், அல்-கின்டி, அல்-ராசி, அல்-பிரூனி, அல்-அசென் என்போர் அடங்குவர். சாபிரின் ஆக்கங்கள், 14 ஆம் நூற்றாண்டின் எசுப்பானியாவைச் சேர்ந்த சியுடோ-கெபெர் என்பவரின் இலத்தீன் மொழிபெயர்ப்புக்கள் ஊடாக ஐரோப்பாவுக்கு அறிமுகமாகின. சியுடோ-கெபெர், கெபெர் என்னும் புனை பெயரில் தானாகவும் சில நூல்களை எழுதியுள்ளார். வேதியியலின் வளர்ச்சியில் இந்திய இரசவாதிகளினதும், உலோகவியலாளர்களினதும் பங்களிப்புகளும் குறிப்பிடத் தக்கவை.

ஐரோப்பாவில் வேதியியலின் எழுச்சி, இருண்ட காலம் என அழைக்கப்படும் காலத்தில் அடிக்கடி ஏற்பட்ட கொள்ளை நோயின் காரணமாகவே ஏற்பட்டது. இது மருந்துகளுக்கான தேவையைக் கூட்டியது. அக்காலத்தில் எல்லா நோயையும் குணப்படுத்தவல்ல "காயகல்பம்" என ஒன்று இருப்பதாகக் கருதினர். ஆனால், இரசவாதக்கல் என்பதைப் போலவே இதையும் எவரும் இதுவரை கண்டுபிடிக்கவில்லை.
இரசவாதத்தைக் கைக்கொண்ட சிலர் அதை ஒரு அறிவார்ந்த செயற்பாடாகவே கருதி வந்தனர். அவர்களிற் சிலர் காலப் போக்கில் முன்னேற்றமான கருத்துக்களையும் முன்வைத்தனர். எடுத்துக்காட்டாக பராசெல்சசு (1493–1541) என்பார், வேதியியல் பொருட்களையும் மருந்துகளையும் குறித்துத் தனக்கு இருந்த தெளிவற்ற புரிதலை வைத்துக்கொண்டு, நான்கு மூலக் கொள்கையை மறுத்து இரசவாதமும் அறிவியலும் கலந்த கலப்புக் கொள்கையொன்றை உருவாக்கினார். இதுபோலவே, கணிதத் துறையில் கூடுதலான கட்டுப்பாடுகளையும், அறிவியல் கவனிப்புக்களில் பக்கச் சார்பை நீக்குவதையும் வலியுறுத்திய மெய்யியலாளர்களான சர் பிரான்சிசு பேக்கன் (1561–1626), ரெனே டேக்கார்ட் (1596–1650) போன்றோரின் செல்வாக்கு அறிவியல் புரட்சிக்கு வித்திட்டது. வேதியியலில், இது ராபர்ட் போயில் (1627–1691) என்பவருடன் தொடங்கியது. இவர் வளிம நிலையின் இயல்புகள் தொடர்பான விதி ஒன்றை வெளிப்படுத்தினார். இது போயில்சின் விதி என அழைக்கப்படுகிறது.
அந்துவான் இலவாசியே என்பவர் 1783 ஆம் ஆண்டில் திணிவுக் காப்புக் கோட்பாட்டையும், 1800ல் ஜான் டால்ட்டன் அணுக் கோட்பாட்டையும் வெளியிட்டனர். உண்மையில் இதன் பின்னரே வேதியியல் முதிர்ச்சியடைந்தது எனலாம். திணிவுக் காப்பு விதியினதும், லவோய்சியரின் முயற்சிகளையே பெரிதும் அடிப்படையாகக் கொண்ட எரிதலுக்கான ஒட்சிசன் கோட்பாடினதும் விளைவாக வேதியியலை மீளுருவாக்கம் செய்யவேண்டி ஏற்பட்டது. எல்லாச் சோதனைகளையும், ஒரே கோட்பாட்டுச் சட்டகத்துள் பொருத்துவதற்கான முயற்சியே இலவோசியே வேதியியலுக்கு அளித்த அடிப்படையான பங்களிப்பு ஆகும்.
இலவோசியே வேதியியல் சமநிலையின் தொடர்ச்சியான பயன்பாட்டை நிலை நிறுத்தினார், ஒட்சிசனைப் பயன்படுத்தி பிளாசித்தன் கோட்பாட்டைத் தூக்கியெறிந்தார், புதிய வேதியியல் பெயரிடல் முறை ஒன்றை உருவாக்கியதுடன் நவீன மீட்டர் அளவு முறைக்கும் பங்களிப்புச் செய்துள்ளார். பழைய, வழக்கொழிந்த வேதியியல் சார்ந்த சொற்களையும் தொழில்நுட்ப மொழியையும் பெரும்பாலும் கல்வியறிவு அற்ற பொதுமக்கள் புரிந்துகொள்ளும் வகையில் மொழிபெயர்ப்பதிலும் இலவோசியே ஈடுபட்டார். இதனால் வீதியியல் குறித்த மக்களின் ஈடுபாடு கூடியது. வேதியியலில் ஏற்பட்ட இத்தகைய முன்னேற்றங்கள் "வேதியியல் புரட்சி" என்று பொதுவாக அழைக்கப்படும் நிலை ஏற்படக் காரணமாயின. இலவோசியேயின் பங்களிப்புக்கள், உலகம் முழுதும் இன்று கல்வி நிலையங்களில் கற்கப்படும் நவீன வேதியியல் உருவாக வழிசமைத்தன. இதனாலும், அவரது பிற பங்களிப்புக்களினாலும் இலவோசியே நவீன வேதியியலின் தந்தை எனப் போற்றப்படுகிறார்.
அடிப்படைக் கருத்துருக்கள்
[தொகு]வேதியியலில் பல்வேறு அடிப்படையான கருத்துருக்கள் உள்ளன. இவற்றுட் சில கீழே விளக்கப்படுகின்றன.
அணு
[தொகு]அணுவே வேதியியலின் அடிப்படையான அலகு. இது நேரேற்றம் கொண்ட மையப் பகுதியையும், அதைச் சுற்றிலும் இலத்திரன்களையும் (எலெக்ட்ரான்) கொண்டிருக்கும். அணுக்கரு என்று அழைக்கப்படும் மையப்பகுதி புரோத்தன் (புரோட்டான்), நியூத்திரன் (நியூட்ரான்) என்னும் துகள்களால் ஆனது. சூழ இருக்கும் இலத்திரன்கள் எதிரேற்றம் கொண்டவை. அதனால், அணுக்கருவின் நேரேற்றத்தைச் சமநிலைப் படுத்துகின்றன. ஒரு தனிமத்தின் இயல்புகளைக் கொண்டிருக்கும் என எதிர்பார்க்கக்கூடிய மிகச் சிறிய துணிக்கையும் அணுவே.
தனிமம்
[தொகு]வேதியியல் தனிமம் என்னும் கருத்துரு வேதியியல் பொருட்கள் என்பதோடு தொடர்புடையது. ஒரு வேதியியல் தனிமம் என்பது அடிப்படையில் ஒரே வகையான அணுக்களைக் கொண்ட ஒரு பொருள். ஒரு குறிப்பிட்ட தனிமம் ஒரு குறித்த எண்ணிக்கை புரோத்தன்களை அதன் அணுக்கருவில் கொண்டிருக்கும். இந்த எண்ணிக்கை அத் தனிமத்தின் அணுவெண் எனப்படும். எடுத்துக் காட்டாக 6 புரோத்தன்களைத் தமது அணுக்கருவில் கொண்ட அணுக்கள் அனைத்தும் கரிமம் என்னும் தனிமத்தில் அணுக்கள். அதேபோல், 62 புரோத்தன்களைக் கொண்ட அணுக்கள் யுரேனியம் என்னும் தனிமத்துக்கு உரியவை.
குறித்த தனிமத்துக்கு உரிய அணுக்கள் அனைத்தும் ஒரே எண்ணிக்கையான புரோத்தன்களைக் கொண்டிருக்கும் எனினும், அவற்றில் உள்ள நியூத்திரன்கள் ஒரே எண்ணிக்கையில் இருக்கவேண்டும் என்பதில்லை. இவ்வாறு ஒரேயளவு புரோத்தன்களையும், வெவ்வேறு எண்ணிக்கையான நியூத்திரன்களையும் கொண்ட அணுக்களையுடைய தனிமங்கள் ஓரிடத்தான்கள் அல்லது சமதானிகள் எனப்படுகின்றன. உண்மையில் ஒரு தனிமத்துக்குப் பல ஓரிடத்தான்கள் இருக்க முடியும். புரோத்தன்களின் எண்ணிக்கையின் அடிப்படையில் 94 வேதியியல் தனிமங்கள் அல்லது அணுவகைகள் இயற்கையில் காணப்படுவதாக அறியப்பட்டுள்ளது. மேலும் 18 வகையான தனிமங்கள் ஆய்வு கூடத்தில் உருவாக்கப்பட்டுள்ளன.
வேதியியல் தனிமங்களைப் பொதுவாக ஆவர்த்தன அட்டவணையில் ஒழுங்கமைக்கின்றனர். இதில் தனிமங்கள் அணுவெண்களின் அடிப்படையிலும், இலத்திரன் அமைப்பின் அடிப்படையில் கூட்டங்களாகவும் பிரிக்கப்பட்டுள்ளன. அட்டவணையில் உள்ள நிரல்கள் கூட்டங்களையும், கிடை வரிசைகள் ஆவர்த்தனங்களையும் குறிக்கின்றன. இவ்வாறு குறிப்பிட்ட கூட்டங்களில் அல்லது ஆவர்த்தனங்களில் இருக்கும் தனிமங்கள் அணு ஆரை, இலத்திரன் இழுதிறன் போன்ற சில பொது இயல்புகளைக் கொண்டவையாக இருக்கின்றன.
சேர்மம்
[தொகு]சேர்மம் என்பது, குறிப்பிட்ட சில வேதியியல் தனிமங்களின் அணுக்களைக் குறிப்பிட்ட விகிதத்திலும், குறிப்பிட்ட ஒழுங்கமைப்பிலும் கொண்டுள்ள ஒரு வேதிப்பொருள். இது கொண்டுள்ள தனிமங்கள் அதன் சேர்க்கையையும், ஒழுங்கமைப்பு சேர்மத்தின் வேதியியல் இயல்புகளையும் தீர்மானிக்கின்றன. எடுத்துக்காட்டாக, "நீர்" என்பது ஐதரசன் (ஹைட்ரஜன்), ஒட்சிசன் (ஆக்சிஜன்) ஆகிய தனிமங்களின் அணுக்களை இரண்டுக்கு ஒன்று என்னும் விகிதத்தில் கொண்டுள்ள ஒரு சேர்மம். இதில், ஒட்சிசன் இரண்டு ஐதரசன் அணுக்களுக்கு நடுவே தம்மிடையே 104.5° கோணத்தை உருவாக்கும்படி பிணைக்கப்பட்டு உள்ளது. சேர்மங்கள் உருவாவதும், அவை ஒன்றிலிருந்து இன்னொன்றாக மாறுவதும் வேதிவினைகளின் காரணமாக நடைபெறுகின்றன.
வேதிப்பொருள்
[தொகு]வேதிப்பொருள் என்பது குறித்த சேர்க்கைப் பொருள்களையும், இயல்புகளையும் கொண்ட ஒரு பொருள். இது சேர்வைகள், தனிமங்கள் அல்லது சேர்வைகள் தனிமங்கள் இரண்டினதும் கலவை ஆகும். அன்றாட வாழ்க்கையில் காணும் பெரும்பலான வேதிப்பொருட்கள் ஏதோ ஒரு வகைக் கலவைகளே. வளி, கலப்புலோகம் போன்றவற்றை எடுத்துக்காட்டாகக் கொள்ளலாம்.
வேதிப்பொருட்களுக்கான பெயரிடல் முறை வேதியியல் மொழியின் முக்கிய பகுதியாகும். பொதுவாக இது வேதியியல் சேர்மங்களுக்குப் பெயரிடும் ஒரு முறையைக் குறிக்கிறது. வேதியியல் வரலாற்றில் தொடக்க காலத்தில் சேர்மங்களுக்கு அவற்றைக் கண்டுபிடித்தவர்களின் பெயரைத் தழுவிப் பெயரிட்டனர். இது பல வகையான குழப்பங்களையும், சிக்கல்களையும் ஏற்படுத்திற்று. இன்று, தூய, பயன்பாட்டு வேதியியலுக்கான பன்னாட்டு ஒன்றியத்தினால் உருவாக்கப்பட்ட முறையைப் பயன்படுத்தி இலகுவாகப் பெயரிட முடிகிறது. வேதியியல் பொருள் வகைகளுக்குப் பெயரிடுவதற்கு சிறப்பாக வரையறுக்கப்பட்ட முறைகள் உள்ளன. கரிமச் சேர்மங்களுக்கு கரிமப் பெயரிடல் முறையும், கனிமச் சேர்மங்களுக்குப் பெயரிடக் கனிமப் பெயரிடல் முறையும் பயன்படுகின்றன. இதைவிட வேதிப்பொருட்களை எண்கள் மூலம் அடையாளம் காணும் முறைகளும் உள்ளன.
மூலக்கூறு
[தொகு]
ஒரு மூலக்கூறு என்பது தூய்மையான வேதியியல் பொருளின் மிகச்சிறிய பிரிக்க முடியாத பகுதியாகும். மூலக்கூறு அதன் தனித்துவமான வேதியியல் பண்புகளைக் கொண்டுள்ளது. அதாவது, ஒரு குறிப்பிட்ட மூலக்கூறு வேதியியல் வினைகளை மற்ற பொருட்களுடன் மேற்கொள்ளும் திறன் கொண்டது. இருப்பினும், இந்த வரையறை மூலக்கூறுகளால் ஆன பொருட்களுக்கு மட்டுமே நன்றாக வேலை செய்கிறது. இது பல பொருட்களில் உண்மையாக இருப்பதில்லை. மூலக்கூறுகள் பொதுவாக சகப்பிணைப்புகளால் பிணைக்கப்பட்ட அணுக்களின் தொகுப்பாகும். அதாவது மூலக்கூற்றின் கட்டமைப்பு மின்சாரம் நடுநிலையானது மற்றும் அனைத்து இணைதிறன் எலக்ட்ரான்களும் பிற எலக்ட்ரான்களுடன் பிணைப்புகளில் அல்லது தனி சோடிகளாக இணைக்கப்படுகின்றன . எனவே, அயனிகள் போலல்லாமல், மூலக்கூறுகள் மின்சார நடுநிலை அலகுகளாக இருக்கின்றன. இந்த விதி உடைக்கப்டும்போது மூலக்கூறுக்கு ஒரு மின்சுமை அளிக்கப்படுகிறது. இதன் விளைவாக சில நேரங்களில் மூலக்கூறு அயனி அல்லது பல்லணு அயனி என்று பெயரிடப்படுகிறது. இருப்பினும், மூலக்கூறு கோட்பாடின் தனித்தியங்கும் மற்றும் தனித்துவமுமான தன்மைக்கு பொதுவாக அணுப்பொருண்மை நிறமாலையின் வெற்றிடத்தில் திருப்பப்பட்ட கற்றை போல மூலக்கூறு அயனிகள் நன்கு பிரிக்கப்பட்ட வடிவத்தில் மட்டுமே இருக்க வேண்டும். மின்சுமையேற்ற பல்லணு அயனிகளின் திரள்கள் திண்மங்களில் காணப்படுகின்றன. பொதுவான சல்பேட்டு அல்லது நைட்ரேட்டு அயனிகளை இதற்கு எடுத்துக் காட்டாக கூறலாம். இவை பொதுவாக வேதியியலில் மூலக்கூறுகள் என்று கருதப்படுவதில்லை. சில மூலக்கூறுகள் ஒன்று அல்லது அதற்கு மேற்பட்ட தனி எலக்ட்ரான்களை பெற்று இயங்குறுப்புகளை உருவாக்கலாம். பெரும்பாலான இயங்குறுப்புகள் ஒப்பீட்டளவில் நல்ல வினைத்திறன் மிக்கவையாகவும் நைட்ரிக் ஆக்சைடு போன்ற சில நிலைப்புத்தன்மையோடும் காணப்படுகின்றன.
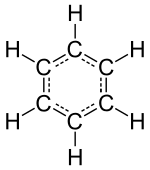
மந்த வாயு தனிமங்களான ஈலியம், நியான், ஆர்கான், கிரிப்டன், செனான் மற்றும் ரேடான் போன்றவை தனி அணுக்களால் ஆக்கப்பட்டுள்ளன. அவ்வணுக்கள் அவற்றின் மிகச்சிறிய தனித்தனியன தனித்தியங்கும் அலகுகள் ஆகும், ஆனால் மற்ற தனிமைப்படுத்தப்பட்ட வேதியியல் தனிமங்கள் மூலக்கூறுகள் அல்லது அணுக்களின் வலை அமைப்புகளால் ஒன்றுடன் ஒன்றாக ஏதோவொரு வழிமுறையில் பிணைக்கப்பட்டுள்ளன அடையாளம் காணக்கூடிய மூலக்கூறுகள் நீர், காற்று போன்ற பழக்கமான பொருட்களையும், ஆல்ககால், சர்க்கரை, பெட்ரோல் மற்றும் பல்வேறு மருந்துகள் போன்ற பல கரிம சேர்மங்களையும் உருவாக்குகின்றன.
இருப்பினும், எல்லா பொருட்களும் அல்லது வேதியியல் சேர்மங்களும் தனித்தியங்கும் மூலக்கூறுகளைக் கொண்டிருக்கவில்லை. உண்மையில் புவி மேலோடு, புவி கவசம் மற்றும் புவி உள்ளகம் போன்ற பெரும்பாலான திண்மப் பொருள்கள் மூலக்கூறுகளற்ற வேதிப்பொருள்களாகும்.
இத்தகைய பிற வகை அயனிச் சேர்மங்கள் மற்றும் வலையமைப்பு சகப் பிணைப்பு திண்மப் பொருள்கள் அடையாளம் காணமுடியாத வகையில் அடுக்கப்பட்டுள்ளன. மாறாக இப்பொருள்கள் மூலக்கூற்று அலகுகள் அல்லது அலகு கூறுகள் வாய்ப்பாட்டு அலகுகளை அடிப்படையாக்க் கொண்டு விவாதிக்கப்பட்டுள்ளன. மேசை உப்பு, கார்பன், மற்றும் வைரம், சிலிக்கா மற்றும் குவார்ட்சு கிரானைட்டு போல சிலிக்கேட்டு கனிமங்கள் போன்ற கனிம உப்புகள் இதற்கு உதாரணங்களாகும். ஒரு மூலக்கூறின் முக்கிய பண்புகளில் ஒன்று அதன் மூலக்கூற்று வடிவியல் அமைப்பாகும். பெரும்பாலும் அது கட்டமைப்பு என்று அழைக்கப்படுகிறது. ஈரணு.,மூவணு, நான்முகி கட்டமைப்பிலுள்ள அணுக்களின் கட்டமைப்பு நேர்க்கோடு, கோண, மற்றும் பட்டைக்கூம்பு படிவத்தில் எளிமையாக இருக்கலாம். ஆறு அணுக்களுக்கு மிகையான பல்லணு மூலக்கூறுகள் கட்டமைப்பு அவற்றின் வேதியியல் தன்மையை தீர்மானிக்கின்றன.
வேதிப்பொருளும் சேர்மமும்
[தொகு]  | |
  | |
  | |
| தூய வேதிப்பொருள்களுக்கு உதாரணங்கள். இடது தொடங்கி வலது வெள்ளீயம் (Sn) மற்றும் கந்தகம் (S), வைரம் கார்பனின் புற வேற்றுமை, தூய சர்க்கரை சுக்ரோசு, சோடியம் குளோரைடு, சோடியம் பைகார்பனேட்டு இரண்டும் அயனிச் சேர்மங்கள். |
திட்டவட்டமான இயைபும் சில பண்புகளின் தொகுப்பையும் கொண்ட ஒரு வகையான பருப்பொருள் வேதிப்பொருள் என்று அழைக்கப்படுகிறது[4]. காற்று மற்றும் உலோகக் கலவைகள் போன்றவை சேர்மத்திற்கு எடுத்துக்காட்டுகளாகும்[5].
மோல் அளவு
[தொகு]மோல் என்பது ஓர் அளவீட்டு அலகு ஆகும், இது வேதிப் பொருளின் அளவைக் குறிக்கிறது இரசாயன அளவு என்றும் அழைக்கப்படுகிறது. சரியாக 0.012 கிலோகிராம் அல்லது 12 கிராம் கார்பனில் காணப்படும் அணுக்களின் எண்ணிக்கை ஒரு மோல் என வரையறுக்கப்படுகிறது, இங்கு கார்பன்-12 அணுக்கள் பிணைப்பற்றும் ஓய்வு நிலையிலும் அடிப்படை நிலையிலும் உள்ளன[6]. ஒரு மோலுக்குள் உள்ள உள்ளீடுகளின் எண்ணிக்கை அவகாட்ரோ மாறிலி என அழைக்கப்படுகிறது, மேலும் இது அனுபவ ரீதியாக சுமார் 6.022 × 1023 மோல் - 1 என தீர்மானிக்கப்படுகிறது. மோலார் அடர்த்தி என்பது கன அளவுக்கு ஒரு குறிப்பிட்ட பொருளின் அளவு ஆகும், இது பொதுவாக மோல் / டெசிமீட்டர்3 என்ற அலகால் தெரிவிக்கப்படுகிறது[7].
வேதியியல் விதிகள்
[தொகு]வேதிவினைகள் சில விதிகளுக்கு அமைவாகவே இடம்பெறுகின்றன. இவை வேதியியலின் அடிப்படைக் கருத்துருக்களாக உள்ளன. அவற்றுட் சில வருமாறு:
- அவகாதரோவின் விதி
- பீர்-லம்பேர்ட்டின் விதி
- போயில்சின் விதி
- சார்லசின் விதி
- கே-லூசாக்கின் விதி
- லே சட்டலியேரின் விதி
- என்றியின் விதி
- எசுவின் விதி
- ஆற்றல் காப்பு விதி
- திணிவுக் காப்பு விதி
வினைகள்
[தொகு]மற்றொரு பொருள் அல்லது சக்தியுடன் ஒரு வேதிப்பொருள் இடைவினை புரிவதன் காரணமாக வேறு ஒரு பொருளாக மாறுகிறது என்றால் அந்த இடைவினையை ஒரு வேதிவினை என்று அழைக்கலாம். எனவே, வேதிவினை என்பது ஒரு பொருளின் வினை தொடர்புடைய கோட்பாடாகக் கருதப்படுகிறது. தொடர்புடைய அவ்வேதிப்பொருள் ஒரு கலவையாகவோ அல்லது கரைசலாகவோ மற்றொரு வேதிப்பொருளுடன் நெருங்கிய தொடர்பு கொள்வது அல்லது ஏதாவது ஒரு சக்திக்கு ஆட்படுவது அல்லது இவ்விரண்டு செயல்களுக்கும் உட்படுவது என்பது வேதிவினை என்ற இக்கோட்பாட்டின் அடிப்படையாகும். இச்செயல்பாட்டின் விளைவாக வினையில் பங்கேற்கும் பொருள்களுக்கு இடையிலும் வினைகலனுக்கு வெளியே உள்ள சுற்றுப்புறத்திலும் ஆற்றல் பரிமாற்றம் நிகழலாம். வினைகலன்கள் என்பவை பெரும்பாலும் ஆய்வகங்களில் பயன்படுத்தப்படும் கண்ணாடிக் கருவிகளாக இருக்கும்.
வேதிவினைகளின் விளைவாக மூலக்கூறுகள் பிரிகை அடையும் செயல் நிகழ்கின்றது. பெரிய மூலக்கூறுகள் உடைந்து சிறிய மூலக்கூறுகளாக மாற்றமடைகின்றன. அல்லது மூலக்கூறுக்குள்ளேயே அவற்றிலுள்ள அணுக்கள் மறுசீரமைப்பு அடைகின்றன. பொதுவாக வேதிவினைகளில் வேதிப் பிணைப்புகள் உடைக்கப்படுகின்றன அல்லது புதிய வேதிப் பிணைப்புகள் உருவாகின்றன. ஆக்சிசனேற்றம், ஒடுக்கம், பிரிகையடைதல், அமிலக் கார நடுனிலையாக்கல், மூலக்கூற்று மறுசீரமைப்பு போன்றவை வேதிவினைகளின் சில வகைகளாகும்.
வேதிவினைகள் பொதுவாக வேதிசமன்பாடுகளில் குறியீடுகளாகச் சித்தரிக்கப்படுகின்றன. அணுக்கரு வினைகள் அல்லாத வேதிவினைகளைக் குறிக்கும் சமன்பாடுகளில் இருபுறமும் ஒரே எண்ணிக்கை மற்றும் ஒரே வகையான அணுக்கள் சமமாக இருக்கும். அணுக்கரு வினைகளைப் பொருத்தவரை அணுக்கருவின் உட்புறத்தில் உள்ள புரோட்டான்கள் மற்றும் நியூட்ரான்களுக்கு மட்டுமே இது பொருந்தும்.
ஒரு வேதிவினையில் வேதிப்பிணைப்புகள் எவ்வாறு படிப்படியாக மறுசீரமைக்கப்படுகின்றன என்பதை ஓர் ஒழுங்குமுறையில் படிப்படியாக எடுத்துக்கூறுவது வினைவழிமுறையாகும். ஒரு வேதிவினையில் பல்வேறு விதமான படினிலைகள் காணப்படலாம். ஒவ்வொரு படினிலையும் வெவ்வேறு வினை வேகத்திலும் நிகழலாம். வினை நிகழும்போது பல்வேறுபட்ட வினை இடைநிலைகள் மாறுபடும் நிலைப்புத்தன்மை கொண்டவையாகவும் இருக்கலாம். வினைவழிமுறைகள் இத்தகைய வினை இயக்கவியலையும், வினையின் இறுதியில் கலப்பாக உருவாகும் வினைவிளை பொருள்களைப் பற்றியும் விளக்க முற்படுகின்றன. பல இயற்பியல் வேதியியலாளர்கள் இத்தகைய பல்வேறு வேதிவினைகளின் வினைவழிமுறைகளை விளக்கிக் கூறுவதில் சிறப்பு நிபுணத்துவம் பெற்றவர்களாக உள்ளனர். பல அனுபவ விதிகள் இதற்காக உருவாக்கப்பட்டன. வேதிவினைகளின் வினைவழிமுறையை முன்மொழிய உட்வார்டு-ஆப்மான் விதிகள் நடைமுறைக்கு வந்தன.
ஒருவகை வேதிப்பொருள் மற்றொரு வகை வேதிப்பொருளாக மாறும் செயல்முறையே வேதிவினை என்று ஐயுபிஏசி முறை வரையறுக்கிறது. இதன்படி வேதிவினை என்பது ஒரு தனிவினையாக நிகழலாம் அல்லது படிப்படியாக நிகழும் வினைகளாக இருக்கலாம். இவ்வரையறையுடன் கூடுதலாக மற்றொரு கருத்தும் சேர்க்கப்படுகிறது. அதாவது வினையின் விளைவாக நிகழும் இடைவினை மாற்றங்கள் சோதனை மூலம் உணரப்படக்கூடியதாக இருக்கவேண்டும் என்ற கருத்து வரையறையுடன் சேர்க்கப்பட்டது.இவ்வாறு உணரக்கூடிய வகையில் நிகழும் வேதிவினைகள் பொதுவாக வரையறையில் குறிப்பிட்டுள்ளவாறு மூலக்கூறுகளின் தொகுதிகள் வினையில் பங்கேற்பதை மட்டும் உறுதி செய்கின்றன. ஆனால் வேதிவினை என்ற சொல் நுண்ணோக்கியளவில் உணரக்கூடிய வேதிவினைகளுக்கும் பொருத்தமாக இருப்பதாகக் கருதலாம்.
குறிப்புகள்
[தொகு]- ↑ "What is Chemistry?". Chemweb.ucc.ie. Archived from the original on 2018-10-03. பார்க்கப்பட்ட நாள் 2011-06-12.
{{cite web}}: Unknown parameter|=ignored (help) - ↑ Chemistry. (n.d.). Merriam-Webster's Medical Dictionary. Retrieved August 19, 2007.
- ↑ Eagle, Cassandra T.; Jennifer Sloan (1998). "Marie Anne Paulze Lavoisier: The Mother of Modern Chemistry" (PDF). The Chemical Educator 3 (5): 1–18. doi:10.1007/s00897980249a. http://www.springerlink.com/content/x14v35m5n8822v42/fulltext.pdf. பார்த்த நாள்: 2007-12-14.
- ↑ Hill, J.W.; Petrucci, R.H.; McCreary, T.W.; Perry, S.S. (2005). General Chemistry (4th ed.). Upper Saddle River, New Jersey: Pearson Prentice Hall. p. 37.
- ↑ M.M. Avedesian; Hugh Baker. Magnesium and Magnesium Alloys. ASM International. p. 59.
- ↑ "Official SI Unit definitions". Bipm.org. பார்க்கப்பட்ட நாள் 2011-06-12.
- ↑ Atkins & de Paula 2009, ப. 9.
