ஐதரசன் பிணைப்பு



ஐதரசன் பிணைப்பு (hydrogen bond) என்பது மூலக்கூறின் சகப்பிணைப்பில் உள்ள ஐதரசன் அணுவிற்கும் வேறொரு வேதி வினைக்குழு அல்லது மூலக்கூற்றிலுள்ள நைட்ரசன், ஆக்சிசன் அல்லது புளோரின் போன்ற அதிக எதிர்மின்ம அணுவிற்கும் இடையே நிகழும் இருமுனை-இருமுனை கவர்ச்சிவிசை காரணமாக உருவாகும் பிணைப்பு ஆகும்.
- இந்தப் பிணைப்பு நிகழ ஐதரசனுடன் பிணைந்துள்ள மற்ற எதிர்மின்ம அணு அதிக எலக்ட்ரான் கவர் ஆற்றலைப் பெற்றிருக்கும் போது பிணைப்பு முனைவுடன் இருக்கும்.
- ஐதரசனுடன் பிணைந்துள்ள மற்ற எதிர்மின்ம அணு உருவளவு சிறியதாக இருக்கும்போது அது பிணைப்பு எலக்ட்ரான் இணையை தன்பால் ஈர்க்கும்.இவ்விரு காரணங்களால்தான் ஐதரசன் பிணைப்பு உருவாகிறது.
ஐதரசன் அணுவுடன் பிணைந்துள்ள அணுவின் உருவளவு சிறியதாகவும் குறைந்த எலக்ட்ரான் கவர் ஆற்றலையும் கொண்டிருந்தால் அங்கு ஐதரன் பிணைப்பு உருவாகாது. நைட்ரசன், ஆக்சிசன் மற்றும் புளோரின் போன்ற தனிமங்கள் அதிக எலக்ட்ரான் கவர் ஆற்றலையும் சிறிய உருவளவையும் கொண்டிருப்பதால் வலிமையான ஐதரசன் பிணைப்புகளைத் தருகின்றன.
ஐதரசன் பிணைப்பின் வகைகள்
[தொகு]மூலக்கூறுகளுக்கிடைப்பட்ட ஐதரசன் பிணைப்பு
[தொகு]பிணைப்புகள் ஒரே அல்லது வேறுபட்ட சேர்மங்களின் இரண்டு மூலக்கூறுகளுக்கு இடையே உருவானால் அது மூலக்கூறுகளுக்கு இடைப்பட்ட ஐதரசன் பிணைப்பு எனப்படுகிறது[2].
திண்ம நிலையில் ஐதரசன் புளோரைடில் ஒழுங்கற்ற சங்கிலியாக ஐதரசன் பிணைப்பால் இணைந்துள்ளன.

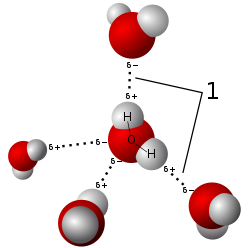
நீர் மூலக்கூறில் எலக்ட்ரான் கவர் ஆக்சிசன் அணு இரண்டு முணைவு சகப்பிணைப்புகளை இரண்டு ஐதரசன் அணுக்களுடன் உருவாக்குகிறது. ஆக்சிசன் அணு அதிக எலக்ட்ரான் கவர் ஆற்றலைப் பெற்றிருப்பதால் பகுதி எதிர்மின் சுமையையும் இரண்டு ஐதரசன் அணுக்களும் பகுதி நேர்மின் சுமையையும் பெற்றுள்ளன. எதிர்மின் சுமை பெற்றுள்ள ஆக்சிசன் அணு இரண்டு நேர்மின் சுமையுடைய ஐதரசன் அணுக்களூடன் பிணைப்பை உருவாக்குகிறது. ஒவ்வொரு ஆக்சிசன் அணுவும் நான்கு ஐதரசன் அணுக்களுடன் நான்முக அமைப்பை ஏற்படுத்துகிறது. H-O-H ஐதரசன் பாலம் உருவாகி முப்பரிமாண நீர் மூலக்கூறு உருவாகிறது.
மூலக்கூறினுள் நிகழும் ஐதரசன் பிணைப்பு
[தொகு]ஒரே மூலக்கூறில் உள்ள ஐதரசன் அணுவிற்கும் நைட்ரசன், ஆக்சிசன் மற்றும் புளோரின் அணுவிற்கும் இடையே உருவாகும் பிணைப்பு மூலக்கூறினுள் நிகழும் ஐதரசன் பிணைப்பு எனப்படும். ஐந்து அல்லது ஆறு அணுக்கள் கொண்ட கரிம வளையச் சேர்மங்களில் இப்பிணைப்பு உருவாகிறது. இதனால் அவற்றின் கரைதிறன் கொதிநிலை முதலியன குறைகின்றன.
எடுத்துக்காட்டு: சாலிசிலிக் அமிலம், சாலிசிலால்டிகைடு.
வரலாறு
[தொகு]ஐதரசன் பிணைப்பு குறித்து முதலில் 1912ஆம் ஆண்டில் டி. எசு. மூரும் டி.எஃப். வின்மில்லும் குறிப்பிட்டுள்ளதாக த நேச்சர் ஆஃப் த கெமிகல் பாண்ட் என்ற நூலில் லினசு கௌலிங் குறிப்பிட்டுள்ளார்.[3] மூரும் வின்மில்லும் டெட்ராமிதைல் அம்மோனியம் ஐட்ராக்சைடை விட ட்ரைமிதைல் அம்மோனியம் ஐட்ராக்சைடு வலுவற்ற காரணமாக இருப்பதற்கு ஐதரசன் பிணைப்பைக் காரணம் காட்டினர். அனைவரும் அறிந்த நீரில் ஐதரசன் பிணைப்பு குறித்த விளக்கத்தை 1920இல் லாடிமெர், ரோடுபுசு வெளியிட்டனர்.[4]
மேற்கோள்கள்
[தொகு]- ↑ Felix H. Beijer, Huub Kooijman, Anthony L. Spek, Rint P. Sijbesma, E. W. Meijer (1998). "Self-Complementarity Achieved through Quadruple Hydrogen Bonding". Angew. Chem. Int. Ed. 37 (1–2): 75–78. doi:10.1002/(SICI)1521-3773(19980202)37:1/2<75::AID-ANIE75>3.0.CO;2-R.
- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "hydrogen bond". Compendium of Chemical Terminology Internet edition.
- ↑ T. S. Moore and T. F. Winmill (1912). "The state of amines in aqueous solution". J. Chem. Soc. 101: 1635. doi:10.1039/CT9120101635. https://archive.org/details/sim_journal-of-the-chemical-society_1912_101_0/page/1635.
- ↑ Latimer, Wendell M.; Rodebush, Worth H. (1920). Journal of the American Chemical Society 42 (7): 1419–1433. doi:10.1021/ja01452a015.
மேலும் படிக்க
[தொகு]- George A. Jeffrey. An Introduction to Hydrogen Bonding (Topics in Physical Chemistry). Oxford University Press, USA (March 13, 1997). பன்னாட்டுத் தரப்புத்தக எண் 0-19-509549-9
- Alexander F. Goncharov, M. Riad Manaa, Joseph M. Zaug, Richard H. Gee, Laurence E. Fried, and Wren B. Montgomery (2005). "Polymerization of Formic Acid under High Pressure". Phys. Rev. Lett. 94 (6): 065505. doi:10.1103/PhysRevLett.94.065505. பப்மெட்:15783746. Bibcode: 2005PhRvL..94f5505G.
- R. Parthasarathi, V. Subramanian, N. Sathyamurthy.Hydrogen Bonding Without Borders: An Atoms-In-Molecules Perspective. J. Phys. Chem. (A) (2006) 110: 3349-3351. http://pubs.acs.org/doi/abs/10.1021/jp060571z
வெளி இணைப்புகள்
[தொகு]- குமிழிச் சுவர் பரணிடப்பட்டது 2014-12-03 at the வந்தவழி இயந்திரம் (இணைப்பு, மேற்பரப்பு இழுவிசை, ஐதரசன் பிணைப்பு ஆகியவற்றை விளக்கும் தேசிய உயர் காந்தப்புல ஆய்வகத்தின் ஒலி வில்லைக் காட்சி)
