டைதயோனேட்டு
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர்
டைதயோனேட்டு
| |||
| முறையான ஐயூபிஏசி பெயர்
பிசு(டிரையாக்சிடோசல்பேட்டு)(S—S)(2−)[1] | |||
| இனங்காட்டிகள் | |||
| 14781-81-8 | |||
| ChEBI | CHEBI:29209 | ||
| ChemSpider | 2339557 | ||
InChI
| |||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 3082075 | ||
| |||
| பண்புகள் | |||
| S 2O2− 6 | |||
| வாய்ப்பாட்டு எடை | 160.126 கிராம் மோல்−1 | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
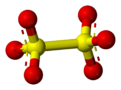
டைதயோனேட்டு (Dithionate) என்பது S2O2−6 என்ற வாய்ப்பாட்டைக் கொண்டிருக்கும் கந்தக ஆக்சோ எதிர்மின் அயனியாகும்[2]. டைதயோனிக் அமிலத்திலிருந்து (H2S2O6) வருவிக்கப்படும் இதை மெட்டாபைசல்பேட்டு எதிர்மின் அயனி என்றும் அழைக்கிறார்கள். இதன் வேதிவாய்ப்பாடு சிலசமயங்களில் அரைக்கட்டமைப்பு வடிவில் [O3SSO3]2− என எழுதப்படுகிறது. அரைக்கட்டமைப்பு என்பது ஒரு மூலக்கூறில் எந்த வரிசைமுறையில் அணுக்கள் இணைந்துள்ளன என்பதைக் குறிக்கும் வரிசையாகும்.
டைதயோனேட்டு அயனியில் S–S பிணைப்பு காணப்படுவதால் கந்தகம் +5 ஆக்சிசனேற்ற நிலையில் உள்ளது. டைதயோனேட்டுகள் பொதுவாக நிலைப்புத் தன்மை மிக்க சேர்மங்களாக உருவாகின்றன. இவை உடனடியாக ஆக்சிசனேற்றமும், ஒடுக்கமும் அடைவதில்லை. வலிமையான ஆக்சிசனேற்றிகள் டைதயோனேட்டுகளை சல்பேட்டுகளாக ஆக்சிசனேற்றம் செய்கின்றன. இதேபோல வலிமையான ஒடுக்கும் முகவர்கள் இவற்றை சல்பைட்டுகளாகவும், டைதயோனைட்டுகளாகவும் ஒடுக்கமடையச் செய்கின்றன[3]. டைதயோனேட்டுகளின் நீர்த்த கரைசல்கள் நிலைப்புத்தன்மை கொண்டுள்ளன, இவற்றை சிதைவடையாமல் கொதிக்கச் செய்ய முடியும்[4].
படிக டைதயோனேட்டின் γ-கதிர்வீச்சு SO−3 தனியுறுப்பு அயனியை உற்பத்தி செய்கிறது. இத்தனி உறுப்பு அயனியிலுள்ள இணையில்லா எலக்ட்ரான்களை எலக்ட்ரான் பாரா காந்த ஒத்திசைவு மூலம் கண்டறிய முடியும்[5]. கதிரியக்கத்தை அளவிட உதவும் கதிரியக்க அளவுமானிக்கு பேரியம் டைதயோனேட்டு பரிந்துரைக்கப்படுகிறது[6]. ஓர் இருபல் ஈந்தணைவியாக டைதயோனேட்டு அயனியால் செயல்பட முடியும்[7]. நீரேற்றான Na2S2O6•2H2O சேர்மத்தின் திடநிலையில் டைதயோனேட்டு அயனியின் கட்டமைப்பு எதிரெதிராகவும், நீரற்ற பொட்டாசியம் உப்பில் டைதயோனேட்டு மறைக்கப்பட்டும் காணப்படுகிறது[3].
சேர்மங்கள்[தொகு]
சோடியம் டைதயோனேட்டு - Na2S2O6 பொட்டாசியம் டைதயோனேட்டு – K2S2O6 பேரியம் டைதயோனேட்டு - BaS2O6 என்பவை டைதயோனேட்டு அயனி இடம்பெற்றுள்ள சேர்மங்களாகும்.
மேற்கோள்கள்[தொகு]
- ↑ "Dithionate(2−) (CHEBI:29209)". Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute.
- ↑ வார்ப்புரு:RedBookRef
- ↑ 3.0 3.1 பாண்டியர் செப்பேடுகள் பத்துGreenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. பன்னாட்டுத் தரப்புத்தக எண் 0080379419.
- ↑ எஃப். ஆல்பர்ட் காட்டன்; சாப்ரி வில்கின்சன்; கார்லோசு முரில்லோ; மேன்பிரட் பாக்மன் (1999), Advanced Inorganic Chemistry (6வது ed.), நியூ யார்க்கு: வைலி-இன்டசயின்சு, பன்னாட்டுத் தரப்புத்தக எண் 0-471-19957-5
- ↑ Radiation Chemistry of Dithionates G.S. Murthy, R.L. Eager, and K.J. McCallum Can. J. Chem. 49(22),(1971), 3733
- ↑ Barium dithionate as an EPR dosemeter Baran M.P., Bugay O.A., Kolesnik S. P., Maksimenko V. M., Teslenko V. V., Petrenko T. L. Desrosiers M. F. Radiation Protection Dosimetry 2006 120, 202; எஆசு:10.1093/rpd/nci531
- ↑ Structures of Some Copper (II) Complexes Containing S2O62− Ion Ishii M. Bulletin of the Yamagata University 5, 1,(2001), 7